 |
AboutOpen | 2022; 9: 52-57 ISSN 2465-2628 | DOI: 10.33393/ao.2022.2432 REVIEW |
 |
Terapia trasfusionale con plasma, piastrine e crioprecipitato
Plasma, platelets and cryoprecipitates therapies
The present review gives an overview of the components, applications and risks of transfusion therapy. Fresh frozen plasma (FFP) transfusion is a widely used procedure both in a prophylactic and therapeutic context. In both scenarios the method of administration and the dosage are, improperly, the same; it is reported that in the clinical context FFP is inappropriately used in over 50% of cases. According to different guidelines its only recommended use is in a condition of critical hemorrhage, as there is no evidence of positive outcomes in its prophylactic administration. Platelet concentrates (PCs) are broadly used to support patients with thrombocytopenia, whether it is pre or postoperative, or in intensive care medicine. The only consensus on its use is the prophylactic administration when the patient’s platelet count is lower than 10,000. Another use of PCs can be in reducing side effects and enhancing the effects of specific drugs, although this application is still complex. Cryoprecipitate usage in clinics is decreasing both due to its variable content of factors I, VIII, XIII and von Willebrand, and the amount of time necessary to obtain it. Of great importance in the transfusion therapy framework are the respiratory complications that can occur, such as Transfusion-Associated Cardiac Overload (TACO), Transfusion-Related Acute Lung Injury (TRALI), Transfusion-Associated Dyspnea (TAD) and transfusion-induced sepsis. The suggested procedure when any of these (and other) complications occur is to seek consultation from the transfusion medicine unit.
Keywords: Blood platelets, Cryoprecipitates, Plasma, Platelet transfusion, Transfusion therapy
Received: May 31, 2022
Accepted: May 31, 2022
Published online: July 31, 2022
AboutOpen - ISSN 2465-2628 - www.aboutscience.eu/aboutopen
© 2022 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
La direttiva europea “Guide to the preparation, use and quality assurance of blood components” definisce gli standard qualitativi per gli emocomponenti tra i quali il plasma fresco congelato (fresh frozen plasma, FFP) ad uso clinico e per la produzione industriale di medicinali plasmaderivati (MPD) (1).
Il suo contenuto è stato recepito a livello nazionale e declinato nel decreto ministeriale del 2 novembre 2015. Le unità di plasma destinate all’uso clinico possono essere costituite dall’emocomponente ottenuto dalla scomposizione di sangue intero (con un volume approssimativamente di 250 mL) oppure dal plasma raccolto direttamente dal donatore, attraverso plasmaferesi produttiva (volume di 600-700 mL) (2).
Se si considera il criterio di appropriatezza d’uso, nel contesto clinico in più del 50% dei casi si ricorre al plasma in modo del tutto inappropriato. In uno studio multicentrico osservazionale, condotto in 29 terapie intensive inglesi, dei pazienti che hanno ricevuto supporto trasfusionale con plasma (12,7%) solamente nel 48% dei casi l’emocomponente è stato trasfuso per un sanguinamento in atto, mentre nel restante 51% dei casi è stato richiesto a scopo puramente profilattico (per una correzione di dati laboratoristici oppure per profilassi peri-procedurale) (3).
Si ricorre al plasma, infatti, sia per prevenire un sanguinamento (indicazione profilattica) sia per arrestarlo (indicazione terapeutica) anche se, per questi due scenari così diversi, vengono utilizzate le stesse modalità oltre che gli stessi quantitativi.
Si tratta pertanto di un approccio di natura quasi fideistica, perché si ritiene che il FFP possa correggere un allungamento dei tempi della coagulazione, partendo dal presupposto che il tempo di coagulazione sia un buon predittore di sanguinamento e che il beneficio potenziale sia molto superiore rispetto al rischio legato alla trasfusione stessa. Dalla letteratura internazionale è noto, invece, come la relazione tra i parametri laboratoristici PT (tempo di protrombina) e aPTT (tempo di tromboplastina parziale attivato) e la concentrazione dei fattori della coagulazione non sia di fatto lineare.
Talora i pazienti possono presentare modeste anomalie dei test di coagulazione standard (PT/aPTT) in assenza di carenze critiche dei fattori della coagulazione che espongano a un rischio emorragico. Inoltre i test tradizionali standard di laboratorio studiano solo la parte plasmatica della coagulazione (5%) senza esplorare il restante 95% dell’assetto coagulativo che è legato, invece, all’interazione sulle superfici cellulari e alla formazione dei complessi coagulativi. Si parte dunque da presupposti che non trovano evidenza dal punto di vista clinico.
Da almeno quindici anni è, inoltre, noto come non vi sia un effetto dose-risposta nella trasfusione di plasma: all’aumentare delle unità che si trasfondono, se si prende un INR (International Normalized Ratio) alterato, la capacità di correzione del suo valore è in realtà molto bassa (4).
Per esempio, per portare un valore di INR di 4,0 a 1,5, bisognerebbe trasfondere 2,5 L di plasma; questo comporterebbe però una diluizione del paziente tale per cui ci si ritroverebbe costretti a trasfondere anche globuli rossi e piastrine (5).
In una revisione sistematica sulla capacità effettiva del plasma fresco di avere una propria rilevanza clinica, in cui sono stati analizzati più di 80 studi randomizzati controllati, è emerso come non vi sia di fatto un beneficio significativo nella maggior parte delle indicazioni cliniche prese in considerazione dall’analisi (6).
Se si considerano le diverse Linee Guida redatte nel corso degli anni passati, partendo dal 2010 con l’American Association of Blood Banks (AABB, 2010), passando al National Blood Authority of Australia (NBA, 2012) e alle German Guidelines (2016), si può notare come un solo punto è comunemente riconosciuto come meritevole: l’utilizzo del plasma fresco congelato in caso di emorragia critica. Non esiste evidenza, invece, sulla somministrazione profilattica di plasma né ancora meno sulla sua trasfusione per correggere livelli di INR che non siano superiori a 2 (7-9).
La Società Europea di Anestesia e Rianimazione (European Society of Anaesthesiology, ESA, 2016) raccomanda con un livello 2C l’utilizzo del plasma nel contesto di protocolli trasfusionali con rapporti fissi (10).
I colleghi inglesi (British Society of Haematology Guidelines, 2018) raccomandano il suo utilizzo nel paziente con emorragia critica, utilizzando strumenti di monitoraggio viscoelastico e sottolineando come il suo ricorso nel ridurre il rischio sia molto limitato per valori di PT tra 1,5 e 1,9 (avere un 1,4 o 1,5 di INR non autorizza di fatto una trasfusione di plasma in assenza di una clinica emorragica) (11).
I colleghi dell’Association of Anaesthetists of Great Britain and Ireland (AAGBI, 2016) suggeriscono di guidare sempre una strategia trasfusionale sulla base di strumenti di monitoraggio (12).
Ugualmente, nelle Society of Cardiovascular Anesthesiologists Guidelines del 2019, si riprende la necessità di monitorare il trattamento e in ogni caso di non procedere a una somministrazione profilattica nemmeno durante interventi di tipo cardiochirurgico (13).
La posizione recente dell’European Society of Intensive Care Medicine (ESICM Guidelines, 2020) è di non utilizzare plasma profilatticamente nel non bleeding e di non trasfonderlo, anche se si è al letto del paziente e se si ha necessità di eseguire procedure invasive, se non è in corso un sanguinamento (14).
Si tratta di raccomandazioni condizionali, ma le evidenze da studi randomizzati sono davvero limitate.
Nel caso di un paziente in terapia anticoagulante e con sanguinamento in atto, in prima linea vanno utilizzati i concentrati del complesso protrombinico; il ricorso alla trasfusione di plasma è riservato ai paesi in cui non sono disponibili i concentrati (15).
Nell’ambito della CID (disseminated intravascular coagulation) l’indicazione è di non somministrare una terapia trasfusionale se il paziente non ha un sanguinamento in atto (16).
Infine, nelle Linee Guida dell’American Association for the Study of Liver Disease del 2020 sono state prese in considerazione le raccomandazioni di quattro associazioni a livello internazionale (Society of Interventional Radiology, American Gastroenterological Association, American College of Gastroenterology, American Association for the Study of Liver Diseases) (17-20).
Solo la Society of Interventional Radiology (2019) raccomanda di mantenere un INR inferiore a 2,5 (18).
Si può dunque concludere come sia ampio il margine di miglioramento sull’utilizzo appropriato di un emocomponente che non è esente da rischi.
Concentrati piastrinici
Benché esistano tre tipologie di concentrati, in Italia se ne utilizzano sostanzialmente due tipi: il concentrato piastrinico da pool di buffy-coat e il concentrato piastrinico da aferesi. Anche i concentrati piastrinici devono rispondere ai requisiti qualitativi previsti dalla normativa vigente, declinati nello stesso decreto ministeriale del 2 novembre 2015 (2).
Il contenuto minimo di piastrine deve essere pari a 2X10¹¹ per il pool di buffy-coat; da aferesi il volume richiesto è di 3X10¹¹, a meno che non si ricorra a un’aferesi da multicomponent.
Nel periodo perioperatorio fisiologicamente nella maggior parte degli interventi chirurgici si attende un calo della conta piastrinica, che generalmente si verifica tra il secondo e il quarto giorno, e, a seguire, invece, ci si aspetta una risalita della conta con il picco massimo atteso attorno al quattordicesimo giorno.
Una quota di pazienti giunge all’intervento chirurgico, in realtà, in una condizione di piastrinopenia. Le principali cause di piastrinopenia in terapia intensiva o nel post-chirurgico sono: pseudopiastrinopenia (artefatto laboratoristico), emodiluizione (estremamente frequente), il consumo, il sequestro, la ridotta produzione e la distruzione su base generalmente immunologica. Gli scenari che si possono presentare nella fase pre-operatoria sono davvero numerosi e una diagnostica differenziale viene sempre imposta.
Le Linee Guida riportano quanto siano bassi i livelli di evidenze sul supporto trasfusionale nell’ambito della chirurgia elettiva, ma anche in corso di procedure in urgenza o invasive.
L’unico dato solido con evidenza forte è la trasfusione profilattica nel paziente con meno di 10.000 piastrine (American Association of Blood Banks, AABB, 2015) (21).
In tutti gli altri scenari, vi sono raccomandazioni o senza grado di evidenza oppure assai deboli.
La stessa ESICM come unica raccomandazione solida indica la trasfusione sotto le 10.000 piastrine mentre in tutti gli altri scenari pone delle raccomandazioni di tipo condizionale (14).
La Linea Guida sviluppata dal gruppo di Medicina di Emostasi Perioperatoria francese riporta in quali scenari si possa pensare di neutralizzare l’effetto dei farmaci e quale sia la sua posizione in termini di quando e quanto supporto trasfusionale fornire con i concentrati piastrinici. Ricorda, in particolare, che, se si volesse neutralizzare parzialmente l’effetto del copidrogel, un unico concentrato piastrinico non sarebbe sufficiente e, soprattutto, che l’efficacia trasfusionale sarebbe ridotta con l’ultima assunzione del farmaco effettuata meno di 6 ore prima (lo stesso vale per il prasugrel). Per il ticagrelor la situazione è ancora più complessa, perché, se il farmaco è stato assunto entro le 24 h, la trasfusione piastrinica risulta inefficace e bisogna attendere 24 h dall’ultima assunzione per neutralizzarne parzialmente l’effetto (22).
L’efficacia della trasfusione piastrinica sulla consistenza del coagulo può essere monitorata con il tromboelastometro/trombelastografo, almeno in termini quantitativi. Nell’esempio qui proposto (Fig. 1) si può osservare un tracciato tromboelastometrico in un paziente cirrotico. A sinistra è rappresentato il basale, prima del supporto trasfusionale piastrinico: la consistenza del coagulo, documentata a 5 e a 10 minuti e poi come Maximum Clott Firmness (MCF), è ridotta. A seguito della supplementazione con concentrato piastrinico da pool di buffy-coat si è osservato un incremento di tutti e tre i parametri (A5, A10, MCF) in termini quantitativi, pur non avendo informazioni sulla loro funzionalità. Se ci si trova di fronte a una problematica di tipo quantitativo, un monitoraggio viscoelastico fornisce in tempi rapidi un’idea dell’efficacia o meno del trattamento.
Crioprecipitato
Oggigiorno il crioprecipitato, ottenuto a partire dal FFP, viene prodotto sempre meno.
Questo emocomponente contiene elevate quantità fattore VIII, di fattore di von Willebrand, di fibrinogeno e di fattore XIII, con una discreta variabilità da donatore a donatore. Deve essere scongelato a 37 °C e infuso immediatamente.
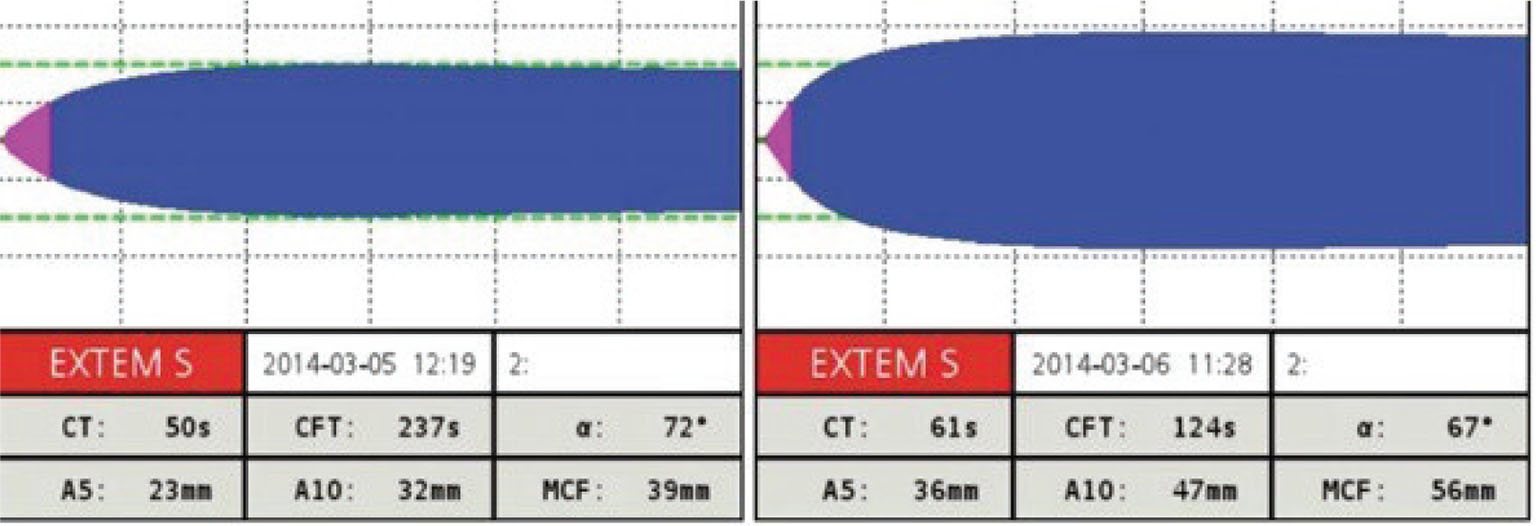
Fig. 1 - Tracciato EXTEM ROTEM® di un paziente cirrotico pre- e post-trasfusione piastrinica (1 concentrato da 5 buffy-coat). CT: clotting time; CFT: clotting formation time; MCF: maximum clot firmness. Per gentile concessione della Dott.ssa Agostini.
Una dose terapeutica di crioprecipitato è costituita generalmente da 10 unità che possono essere trasfuse singolarmente, come avviene in Italia, o a seguito del pooling, come avviene nel mondo anglossasone (2 pool di 5 unità ciascuno).
Anche in questo caso è necessario rispettare dei criteri qualitativi sempre indicati nel decreto ministeriale del 2 novembre 2015 (2).
I controlli di qualità prevedono la misurazione dei livelli di fattore VIII a garanzia di un corretto processo produttivo. Dato che viene ottenuto da un singolo donatore, a seconda delle sue caratteristiche, il quantitativo dei singoli fattori potrà essere estremamente differente.
Nell’esempio qui riportato (Fig. 2), si può osservare la somministrazione di 10 unità di crioprecipitato in un paziente con trauma maggiore. Il tracciato basale è di 5 mm in A10 (circa 100 mg/dL di fibrinogeno Clauss). Ad avvenuta trasfusione, la risposta è assolutamente positiva perché si è passati a 11 mm in A10 (ben sopra i 150 mg/dL circa).
Diversi sono gli studi presenti in letteratura che hanno cercato di confrontare la trasfusione di crioprecipitato rispetto al concentrato di fibrinogeno. Per esempio in uno studio di fattibilità nel contesto del trauma maggiore, è emerso che, per ottenere il crioprecipitato, occorrono mediamente 90 minuti. Un tempo sicuramente maggiore rispetto a quello richiesto per un concentrato (23).
Strategie trasfusionali in un contesto di sanguinamento critico
Le strategie sono fondamentalmente di tre tipi: l’approccio formula-driven (una unità di emazie, una di plasma da 250 mL e una di concentrato piastrinico), l’approccio individualizzato (goal-directed) e quello Lab-driven (quasi ormai del tutto abbandonato).
In Europa esiste una disomogeneità in termini di utilizzo di pacchetti trasfusionali. Un lavoro a tal proposito si è proposto di comparare i pacchetti trasfusionali in sei trauma center europei. I risultati hanno messo in evidenza come le scelte siano assai differenti: chi parte con emazie e plasma, chi utilizza anche le piastrine e aggiunge fibrinogeno solo in seconda battuta e chi parte direttamente con emazie, plasma di produzione industriale e concentrato piastrinico (24).
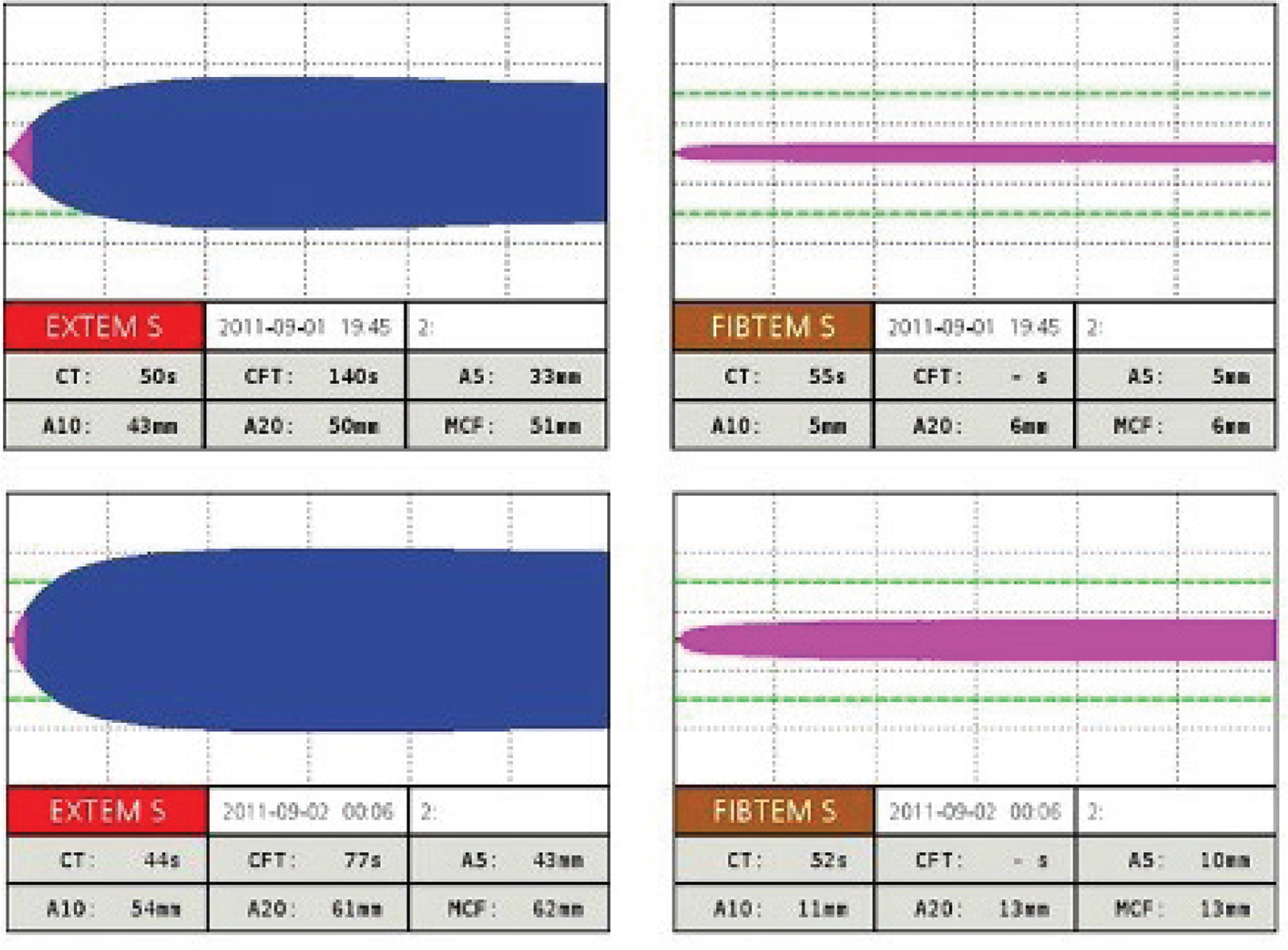
Fig. 2 - Tracciato EXTEM ROTEM® di un paziente con trauma maggiore pre- e post-trasfusione con crioprecipitato. CT: clotting time; CFT: clotting formation time; MCF: maximum clot firmness. Per gentile concessione della Dott.ssa Agostini.
Conclusioni
Di grande interesse in questo senso sono le complicanze respiratorie, in particolare: il sovraccarico circolatorio indotto dalla trasfusione (TACO, Transfusion-Associated Cardiac Overload), la TRALI (Transfusion-Related Acute Lung Injury) e la dispnea associata alla trasfusione (TAD, Transfusion-Associated Dyspnea) oltre che la sepsi da trasfusione piastrinica. In quest’ultimo caso (trasfusione con concentrati), l’incidenza comparata con quella dopo trasfusione di globuli rossi (1:250.000) è pari a 1:10.000. Ogni volta che c’è il sospetto di reazione indesiderata alla trasfusione è importante la segnalazione alla medicina trasfusionale perché in grado di fare a ritroso le valutazioni in termini di segnalazione di emovigilanza. Le unità che si ricevono per norma devono essere sempre ispezionate prima di procedere con l’evento trasfusionale.
La TRALI è un’insufficienza respiratoria acuta che generalmente compare entro sei ore dalla trasfusione (Tab. I), con una frequenza di un evento ogni 5.000 unità.
Oggi si distinguono: la TRALI di tipo 1, nel paziente che non ha fattori di rischio per un’ARDS con esordio acuto, ipossiemia e presenza documentata di infiltrati bilaterali e che non ha evidenza di ipertensione atriale sinistra (e deve esserci il fattore temporale); la TRALI di tipo 2, nel paziente che può avere fattori di rischio per ARDS ma che non ha un’ARDS diagnosticata (25).
La TRALI è stata inizialmente considerata come una complicanza di tipo immunologico; dal 2008, in Italia e nel resto del mondo, sono state attuate delle strategie per la sua prevenzione, per cui il plasma ad uso clinico viene ottenuto solamente da donatori di sesso maschile o da donne che siano nullipare (con la difficoltà a volte di avere il dato di eventuali aborti). Esistono inoltre una TRALI che è causata da fattori dipendenti dal paziente e una causata da fattori legati al processo produttivo trasfusionale.
| 1. TRALI | |
|
a ALI I. Esordio acuto II. Ipossiemia - Research setting: PaO2/FiO2 ≤ 300 o SpO2 < 90% in aria ambiente - Non research setting: PaO2/FiO2 ≤ 300 o SpO2 < 90% in aria ambiente o altra evidenza clinica di ipossiemia III. Infiltrati bilaterali alla radiografia del torace in proiezione frontale IV. Nessuna evidenza di ipertensione atriale sinistra (p. es., sovraccarico circolatorio) b Nessuna ALI preesistente alla trasfusione c Durante la trasfusione o entro 6 ore da essa d Nessuna relazione temporale con un fattore di rischio alternativo per ALI |
|
| 2. Possibile TRALI | |
|
a ALI b Nessuna ALI preesistente alla trasfusione c Durante la trasfusione o entro 6 ore da essa d Una chiara relazione temporale con un fattore di rischio alternativo per ALI |
|
Il TACO è particolarmente frequente (1:100 unità trasfuse). Ci devono essere un criterio temporale rispetto all’evento trasfusionale (insufficienza respiratoria con edema polmonare nelle 12 h dall’evento), almeno un criterio maggiore e i criteri minori (è necessario fare il dosaggio del peptide natriuretico) (Tab. II).
| Pazienti classificati con TACO (diagnosi surveillance) devono manifestare almeno uno dei criteri richiesti* con un esordio durante o fino a 12 ore dopo la trasfusione (SHOT continua ad accettare casi fino a 24 ore) e un totale di 3 o più criteri, p. es., *A e/o B e un totale di almeno 3 (A-E) |
| *Criteri richiesti (A e/o B) |
|
A Compromissione respiratoria acuta o in peggioramento e/o B Evidenza di un edema acuto o in peggioramento basato su: • controllo medico e/o • imaging radiografico del torace e/o altre valutazioni non invasive della funzione cardiaca |
| Criteri aggiuntivi |
|
C Evidenza di cambiamenti a carico del sistema cardiovascolare non spiegabili dalla condizione medica sottostante del paziente, inclusi: sviluppo di tachicardia, ipertensione, distensione venosa giugulare, ingrossamento del cuore e/o edema periferico D Evidenza di sovraccarico di liquidi compreso uno qualsiasi dei seguenti: un bilancio di liquidi positivo, un miglioramento clinico dopo la diuresi E Risultati di supporto di un biomarker rilevante, p. es., un aumento dei livelli del peptide natriuretico di tipo B (BNP) o del frammento amino-terminale del pro peptide natriuretico di tipo B (NT-pro BNP) superiore a 1,5 volte il valore pre-trasfusionale |
I colleghi inglesi hanno sviluppato una check list (TACO check list) mandatoria per identificare i pazienti che possono essere a rischio di sviluppare un TACO (26).
È inoltre in corso uno studio per valutare se la somministrazione profilattica di diuretici riduca l’incidenza del TACO.
Per concludere, la TAD è, invece, un distress respiratorio che si verifica entro le 24 h dal supporto trasfusionale, una condizione che non deve avere i requisiti né della TRALI né del TACO.
Acknowledgements
We would like to thank Antonella Managò and Francesca La Rosa who, on behalf of Health Publishing & Services Srl, provided publishing support and journal styling services.
Disclosures
Conflict of interest: The Authors declare no conflict of interest.
Financial support: CSL Behring funded the publishing support and journal styling services. CSL Behring had no role in the conduct of the research, preparation of the article, study design, the collection, analysis and interpretation of data, the writing of the report, and in the article for publication.
Bibliografia
- 1. European Committee (Partial Agreement) on Blood Transfusion. (CD-P-TS). Guide to the preparation, use and quality assurance of blood components. In: EDQM 20th Edition.; 2020. Online
- 2. Gazzetta Ufficiale della Repubblica Italiana. Ministero della Salute. Decreto 2 novembre 2015. Disposizioni relative ai requisiti di qualità e sicurezza del sangue e degli emocomponenti. (15A09709). GU Serie Generale n.300 del 28-12-2015 - Suppl. Ordinario n.69. Accessed May 4, 2022. Online
- 3. Stanworth SJ, Walsh TS, Prescott RJ, Lee RJ, Watson DM, Wyncoll D; Intensive Care Study of Coagulopathy (ISOC) investigators. A national study of plasma use in critical care: clinical indications, dose and effect on prothrombin time. Crit Care. 2011;15(2):R108-R108. CrossRef PubMed
- 4. Abdel-Wahab OI, Healy B, Dzik WH. Effect of fresh-frozen plasma transfusion on prothrombin time and bleeding in patients with mild coagulation abnormalities. Transfusion. 2006;46(8):1279-1285. CrossRef PubMed
- 5. Holland LL, Brooks JP. Toward rational fresh frozen plasma transfusion: the effect of plasma transfusion on coagulation test results. Am J Clin Pathol. 2006;126(1):133-139. CrossRef PubMed
- 6. Stanworth SJ, Brunskill SJ, Hyde CJ, McClelland DBL, Murphy MF. Is fresh frozen plasma clinically effective? A systematic review of randomized controlled trials. Br J Haematol. 2004;126(1):139-152. CrossRef PubMed
- 7. Roback JD, Caldwell S, Carson J, et al; American Association for the Study of Liver; American Academy of Pediatrics; United States Army; American Society of Anesthesiology; American Society of Hematology. Evidence-based practice guidelines for plasma transfusion. Transfusion. 2010;50(6):1227-1239. CrossRef PubMed
- 8. National Blood Authority of Australia. Patient Blood Management Guidelines. 2012. Accessed May 4, 2022. Online
- 9. Executive Committee of the German Medical Association on the Recommendation of the Scientific Advisory Board. Cross-Sectional Guidelines for Therapy with Blood Components and Plasma Derivatives: Chapter 5 Human Albumin - Revised. Transfus Med Hemother. 2016;43(3):223-232. CrossRef PubMed
- 10. Kozek-Langenecker SA, Ahmed AB, Afshari A, et al. Management of severe perioperative bleeding: guidelines from the European Society of Anaesthesiology: First update 2016. Eur J Anaesthesiol. 2017 Jun;34(6):332-395. CrossRef PubMed
- 11. Green L, Bolton-Maggs P, Beattie C, et al. British Society of Haematology Guidelines on the spectrum of fresh frozen plasma and cryoprecipitate products: their handling and use in various patient groups in the absence of major bleeding. Br J Haematol. 2018;181(1):54-67. CrossRef PubMed
- 12. Klein AA, Arnold P, Bingham RM, et al. AAGBI guidelines: the use of blood components and their alternatives 2016. Anaesthesia. 2016;71(7):829-842. CrossRef PubMed
- 13. Raphael J, Mazer CD, Subramani S, et al. Society of Cardiovascular Anesthesiologists Clinical Practice Improvement Advisory for Management of Perioperative Bleeding and Hemostasis in Cardiac Surgery Patients. Anesth Analg. 2019;129(5):1209-1221. CrossRef PubMed
- 14. Vlaar AP, Oczkowski S, de Bruin S, et al. Transfusion strategies in non-bleeding critically ill adults: a clinical practice guideline from the European Society of Intensive Care Medicine. Intensive Care Med. 2020;46(4):673-696. CrossRef PubMed
- 15. Makris M, Van Veen JJ, Tait CR, Mumford AD, Laffan M; British Committee for Standards in Haematology. Guideline on the management of bleeding in patients on antithrombotic agents. Br J Haematol. 2013;160(1):35-46. CrossRef PubMed
- 16. Wada H, Thachil J, di Nisio M, et al. Guidance for diagnosis and treatment of disseminated intravascular coagulation from harmonization of the recommendations from three guidelines. J Thromb Haemost. 2013;11(4):761-767. CrossRef
- 17. Northup PG, Garcia-Pagan JC, Garcia-Tsao G, et al. Vascular Liver Disorders, Portal Vein Thrombosis, and Procedural Bleeding in Patients With Liver Disease: 2020 Practice Guidance by the American Association for the Study of Liver Diseases. Hepatology. 2021;73(1):366-413. CrossRef PubMed
- 18. Patel IJ, Rahim S, Davidson JC, et al. Society of Interventional Radiology Consensus Guidelines for the Periprocedural Management of Thrombotic and Bleeding Risk in Patients Undergoing Percutaneous Image-Guided Interventions-Part II: Recommendations: Endorsed by the Canadian Association for Interventional Radiology and the Cardiovascular and Interventional Radiological Society of Europe. J Vasc Interv Radiol. 2019;30(8):1168-1184.e1. CrossRef PubMed
- 19. O’Leary JG, Greenberg CS, Patton HM, Caldwell SH. AGA Clinical Practice Update: coagulation in Cirrhosis. Gastroenterology. 2019;157(1):34-43.e1. CrossRef PubMed
- 20. Simonetto DA, Singal AK, Garcia-Tsao G, Caldwell SH, Ahn J, Kamath PS. ACG Clinical Guideline: Disorders of the Hepatic and Mesenteric Circulation. Am J Gastroenterol. 2020 Jan;115(1):18-40. CrossRef PubMed
- 21. Kaufman RM, Djulbegovic B, Gernsheimer T, et al; AABB. Platelet transfusion: a clinical practice guideline from the AABB. Ann Intern Med. 2015;162(3):205-213. CrossRef PubMed
- 22. Godier A, Albaladejo P, On Perioperative Haemostasis Gihp Group TFWG; On Perioperative Haemostasis Gihp Group TFWG. Management of Bleeding Events Associated with Antiplatelet Therapy: Evidence, Uncertainties and Pitfalls. J Clin Med. 2020;9(7):2318. CrossRef PubMed
- 23. Curry N, Rourke C, Davenport R, et al. Early cryoprecipitate for major haemorrhage in trauma: a randomised controlled feasibility trial. Br J Anaesth. 2015;115(1):76-83. CrossRef PubMed
- 24. Schäfer N, Driessen A, Fröhlich M, Stürmer EK, Maegele M; TACTIC partners. Diversity in clinical management and protocols for the treatment of major bleeding trauma patients across European level I Trauma Centres. Scand J Trauma Resusc Emerg Med. 2015;23(1):74. CrossRef PubMed
- 25. Grey S, Bolton-Maggs P. Pulmonary complications of transfusion: Changes, challenges, and future directions. Transfus Med. 2020;30(6):442-449. CrossRef PubMed
- 26. Narayan S, ed. Poles D et al. The Serious Hazards of Transfusion (SHOT) Steering Group. The 2018 Annual SHOT Report (2019). Online (Accessed May 2022)
- 27. Kleinman S, Caulfield T, Chan P, et al. Toward an understanding of transfusion-related acute lung injury: statement of a consensus panel. Transfusion. 2004;44(12):1774-1789. CrossRef PubMed
- 28. Andrzejewski C. BMPGS et al. International Society of Blood Transfusion, Working Party on Haemovigilance in collaboration with The International Haemovigilance Network and AABB (formerly the American Association of Blood Banks). Transfusion-associated circulatory overload (TACO). Definition; 2018. Online (Accessed January 2021).