 |
AboutOpen | 2022; 9: 61-65 ISSN 2465-2628 | DOI: 10.33393/ao.2022.2426 REVIEW |
 |
Gestione dell’emorragia ostetrica
Major obstetric hemorrhage management
Postpartum hemorrhage (PPH) is to this day one of the leading causes of maternal death and its diagnosis is still highly subjective, as it relies on unprecise estimates of the amount of blood loss. There are three areas in which PPH outcomes can be improved: prevention, treatment and rescue. PPH can escalate to a graver clinical picture of Severe Acute Maternal Morbidity (SAMM) due to an inaccurate estimate of the blood loss, inability to identify an at-risk patient, delays in testing and availability of hemoderivatives, and lack of clear guidelines and interdisciplinary communication. Many factors can predispose to PPH and in clinical practice the many causes of its insurgence are summarized with the 4T formula: Tone (uterine atony), Trauma (laceration/hematoma), Tissue (retained tissue/invasive placenta), Thrombin (coagulation).
Some precautions can be taken in preventing PPH such as the use of uterotonics, the administration of oxytocin, the timing of umbilical cord clamping, and the monitoring of anemia and the platelet to fibrinogen concentration ratio. In recent years studies have been published with the goal of leading PPH diagnosis and management through universal guidelines, point-of-care testing and interdisciplinary approaches. The proposed algorithms, albeit not yet validated, are useful in the clinical practice; similarly beneficial is the use of reliable predictive panels such as the Modified Early Obstetric Warning System.
Keywords: Blood coagulation, Obstetric Labor Complications, Postoperative hemorrhage, Postpartum hemorrhage, Pregnancy complications
Received: May 19, 2022
Accepted: May 24, 2022
Published online: July 31, 2022
AboutOpen - ISSN 2465-2628 - www.aboutscience.eu/aboutopen
© 2022 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
L’emorragia post-partum (EPP) rimane una delle principali cause di morte materna in tutto il mondo e si stima che causi la morte di una donna ogni 10 minuti (1).
L’EPP è comunemente definita come una perdita di sangue superiore a 500 millilitri (mL) dopo il parto vaginale e a 1.000 mL dopo il parto cesareo (2).
Tuttavia le definizioni variano e la diagnosi di EPP è soggettiva, spesso basandosi su stime imprecise della perdita di sangue. La perdita è da considerarsi fisiologica al di sotto di 500 mL di sangue e si parla di EPP minore tra 500 e 1.000 mL, a prescindere dalle modalità di espletamento del parto. Perdite di sangue superiori a 1.000 mL rientrano nella definizione di EPP maggiore e, a loro volta, possono essere controllate se richiedono un monitoraggio attivo per mantenere un equilibrio emodinamico nella puerpera; sono invece definite persistenti se vi è una compromissione della stabilità emodinamica materna. Per valori di perdite di sangue superiori a 2.000 mL, si rientra in un quadro clinico di emorragia massiva che può condurre all’exitus se non vi è un tempestivo trattamento.
Tre sono le grandi aree di intervento in cui gli esiti dell’EPP possono essere migliorati: i) prevenzione, ii) trattamento e iii) rianimazione.
La maggior parte delle partorienti si colloca in una finestra di perdita sotto i 1.000 mL, quindi nell’ambito della prevenzione. Tra i 1.000 mL e i 2.000 mL è possibile agire tempestivamente con trattamenti mirati che tengano sotto controllo l’emorragia. Per valori, invece, di perdite maggiori di 2.000 mL, si entra in una zona a rischio di morte. In questa fase è fondamentale una gestione attiva in strategia di equipe (1).
Lo shock emorragico viene definito come un’ipoperfusione tissutale risultante da una diminuzione acuta e prolungata del volume sanguigno circolante. I fattori che ne influenzano la gravità sono: i) la velocità con cui si sviluppa l’emorragia; ii) la consistenza del volume di sangue perduto; iii) l’efficienza dei meccanismi di compensazione; iv) la possibilità di controllare l’emostasi.
Tutti questi fattori vanno considerati prestando attenzione al fatto che le donne gravide presentano un assetto coagulativo nettamente diverso che le protegge dal rischio emorragico durante la gravidanza ma che le espone a tale rischio in maniera esponenziale dopo il secondamento.
È stato stimato che in casi di emorragia massiva, in assenza di trattamenti, l’esito di exitus avviene in 2 ore per emorragia post-partum e in 12 ore in caso di emorragia ante-partum. In quest’ultimo caso, i tempi sono più lunghi perché la donna si trova ancora in un assetto coagulativo protettivo.
La morbosità materna grave acuta
La morbosità materna grave acuta (Severe Acute Maternal Morbidity, SAMM) è anche nota come near miss, definita dall’OMS come il caso di una donna che sarebbe presumibilmente morta ma che, invece, è sopravvissuta a complicazioni insorte durante la gravidanza, il parto e fino a 42 giorni dal termine della gravidanza stessa. Le donne che sopravvivono a condizioni potenzialmente letali, derivate da complicazioni legate alla gravidanza e al parto, hanno molti aspetti in comune con coloro che muoiono per tali complicanze. Questa somiglianza ha portato allo sviluppo del concetto di mancato incidente nella salute materna.
È stato dimostrato che fattori sociodemografici (p. es., esclusione sociale, povertà, scarsa cura prenatale), clinici (p. es., anemia prenatale) e di altro tipo (p. es., personale clinico esperto, disponibilità di farmaci e di emoderivati, buoni servizi di maternità ecc.) influenzano la progressione di una donna lungo il continuum di morbilità e mortalità (3).
I fattori che predispongono la partoriente a SAMM sono:
- EPP > 1.500 mL;
- Diminuzione della concentrazione di emoglobina (Hb) peri-partum ≥ 4 g/dL;
- trasfusione acuta, ≥ 4 unità di sangue;
- coagulazione intravascolare disseminata (DIC) o shock;
- necessità di ulteriori procedure non ostetriche (p. es., radiologia interventistica/isterectomia/laparotomia);
- perdita di sangue che porta alla compromissione di organi vitali;
- ricovero in terapia intensiva.
Gli errori più comuni nella gestione dell’EPP che portano la paziente a SAMM sono legati principalmente a stime errate della perdita di sangue, che spesso viene sottovalutata, generando un ritardo nel trattamento che può risultare non appropriato in mancanza dell’identificazione eziologica. Un altro fattore molto frequente è l’incapacità di indentificare la paziente a rischio e di conseguenza di essere proattivi nella gestione della situazione. Altri ritardi, come per esempio quelli nella diagnostica di laboratorio, nella disponibilità di emoderivati e nell’individuazione del limite tra fisiologia e criticità, possono compromettere gli esiti dei trattamenti. Infine, la mancanza di algoritmi e di Linee Guida unita a una competenza e a una formazione insufficienti, a una comunicazione interdisciplinare inefficace e a un’organizzazione inadeguata è un fattore sfavorevole nella gestione dell’EPP.
Le misure di prevenzione prevedono l’identificazione precoce dei casi a rischio, buone pratiche cliniche e una comunicazione efficiente tra le diverse figure professionali coinvolte.
I fattori associati a un rischio basso di EPP possono essere: gravidanza singola, ≤ 4 parti vaginali, disturbi emorragici non noti e nessuna storia di EPP e di incisione intrauterina precedente. I fattori che predispongono la partoriente a un rischio medio di EPP possono essere: EPP pregressa, precedente/i parto/i cesareo/i o chirurgia uterina, gestazione multipla, > 4 parti precedenti, corioamnionite (anche causa di sepsi), storia di EPP, stima fetale > 4 kg e obesità patologica (indice di massa corporea, IMC, > 35). Invece, i fattori associati a un rischio elevato possono essere: placenta previa, sospetta placenta accreta o percreta, Ht (ematocrito) < 30 o altri fattori di rischio, Plt (piastrine) < 100.000 e sanguinamento attivo e coagulopatia nota (4).
Tuttavia, molti casi di emorragia post-partum non presentano fattori di rischio identificabili. L’EPP può verificarsi in qualsiasi gravidanza e la maggior parte delle donne con EPP (61%) non ha fattori di rischio diversi dall’età materna e dal taglio cesareo (5).
Cause di EPP
Le cause di EPP possono essere molteplici. Nella pratica clinica vengono riassunte sinteticamente attraverso la formula delle “4T” (6,7):
- tono (in relazione alle possibili anomalie della contrazione uterina, nel 70% dei casi atonia uterina);
- tessuto (per la ritenzione di tessuto amniocoriale o placenta ritenuta, 10% dei casi);
- trauma (per esempio, lacerazioni cervicali, vaginali o del perineo, inversione uterina, 20% dei casi);
- trombina (in relazione ad anomalie congenite o acquisite della coagulazione e a disordini emocoagulativi dovuti a disfunzione della trombina, 1% dei casi).
In caso di segni clinici di coagulopatia non è necessario attendere i risultati di laboratorio per iniziare il trattamento trasfusionale. Questi possono includere: trasudato dai siti di iniezione della puntura o dal campo operatorio, ematuria, petecchie, emorragie della congiuntiva o delle mucose e atonia uterina secondaria a un aumento dei prodotti di degradazione del fibrinogeno. I segni di laboratorio possono includere: PLT < 50 x 10⁹/L, PT > 1,5 rispetto al normale, INR > 1,5, aPTT > 1,5 rispetto al normale, concentrazione di fibrinogeno < 2,0 g/L.
Durante la gravidanza si verificano vari cambiamenti nella fisiologia della coagulazione. Vi sono un aumento dell’attività dei fattori procoagulanti e una diminuzione di alcuni fattori anticoagulanti naturali e della fibrinolisi. Si osservano un aumento del fattore di von Willebrand, dei fattori II, VII, VIII e X e dell’inibitore dell’attivatore di plasminogeno di tipo 1 e una diminuzione della proteina S insieme a un aumento alla resistenza alla proteina C reattiva. Per molti di questi cambiamenti, sono state stabilite strette correlazioni con i cambiamenti ormonali della gravidanza e in particolare con l’aumento dei livelli sierici di estradiolo (8).
Altro fenomeno caratteristico della gravidanza e di cui tenere conto è la plethora gravidarium, caratterizzata da un aumento della gittata cardiaca dal 30% al 50% a partire dalla sesta settimana. Contestualmente, il volume totale di sangue aumenta in modo proporzionale alla gittata cardiaca ma l’aumento del volume plasmatico è maggiore rispetto alla massa dei globuli rossi. In queste condizioni: il volume plasmatico aumenta del 48%, pari a 1.250 mL, la massa eritrocitaria aumenta del 18%, pari a 250 mL, l’ematocrito (Htc) si riduce dal 40% al 33% e l’emoglobina viene ridotta per diluizione (da 13,3 a circa 12,1 g/dL). Il tutto comporta un’ipervolemia protettiva in gravidanza che ha come effetto la riduzione della viscosità ematica e il miglioramento della perfusione placentare, favorendo gli scambi materno fetali di gas e sostanze nutritive.
È molto importante, inoltre, valutare l’anemia in gravidanza. Nelle donne in gravidanza, concentrazioni di emoglobina ≥ 10 gr/dL vengono considerate fisiologiche. Per valori di emoglobina che vanno da 100 g/L fino a valori < 70 g/L, si considera un quadro di anemia da lieve a severo. A valori elevati di ematocrito, i globuli rossi occupano la parte centrale del flusso sanguigno, spingendo le piastrine verso le pareti del vaso. Ciò induce un’interazione migliore tra le piastrine e la parete del vaso in caso di danno.
L’Istituto Superiore di Sanità raccomanda un esame emocromocitometrico completo all’inizio della gravidanza e alla settimana 28 per consentire un trattamento ottimale dell’anemia.
Dovrebbero essere indagati i casi con livelli di emoglobina inferiori alla norma per il periodo della gravidanza (Hb < 11 g/100 mL nel primo trimestre e Hb < 10,5 g/100 mL a partire dalla 28a settimana) e dovrebbe essere prescritta una terapia adeguata, fornendo alle donne informazioni sui possibili effetti collaterali. Il dosaggio della ferritina sierica è sufficiente per la diagnosi di anemia sideropenica: un valore < 30 μg/L è prova di carenza di ferro e anemia sideropenica.
È inoltre importante la conta delle piastrine in relazione alla concentrazione di fibrinogeno. Questo rapporto può indicare un rischio aumentato di EPP.
Per gestire al meglio il rischio di EPP nelle pazienti si fa riferimento alla matrice dei tre pilastri della gestione del sangue del paziente che consiste nell’ottimizzare l’ematopoiesi (1° pilastro), nel ridurre il bleeding (2° pilastro) e nell’ottimizzare la tolleranza all’anemia (3° pilastro). Il tutto richiede un approccio di tipo multidisciplinare (9).
Prevenzione dell’EPP nel parto vaginale: trattamento attivo del III stadio
Alcuni accorgimenti possono aiutare a prevenire l’EPP nel parto vaginale: tra questi, l’uso di uterotonici dopo l’espulsione della spalla anteriore o del feto (ossitocina 10 UI/im), il clampaggio del cordone ombelicale non prima di 1-3 minuti dopo l’espulsione del feto e la trazione controllata del cordone solo dopo somministrazione di ossitocina e una volta verificati i segni di distacco di placenta. Si ha diagnosi di III stadio prolungato a 30 minuti dalla nascita, se è stata somministrata ossitocina, altrimenti a 60 minuti nell’approccio fisiologico.
È raccomandabile informare la paziente prima del parto riguardo alle diverse opzioni per la gestione della terza fase e consigliare la somministrazione di ossitocina, perché associata a un rischio ridotto di emorragia post-partum (10 UI/im di ossitocina dopo l’espulsione della spalla anteriore).
Se una donna a basso rischio di EPP richiede un approccio fisiologico senza ossitocina, si raccomanda di informarla in dettaglio dei benefici associati al trattamento. Se la donna, dopo aver ricevuto queste informazioni, conferma la valutazione personale del rapporto beneficio/danno favorevole all’approccio fisiologico, si raccomanda di supportarla in questa scelta, documentando l’assistenza del travaglio concordata nella cartella (p. es., compilazione del piano parto).
L’ossitocina è il farmaco di scelta per la prevenzione dell’EPP anche nel parto cesareo. Una dose di ossitocina endovenosa di 3-5 U/ev è raccomandata nelle donne a basso rischio di EPP dopo cesareo, seguita da una lenta infusione di 8-10 U/ora in soluzione isotonica in 2-4 ore.
Segni clinici e sintomi dell’EPP
Come precedentemente riportato, la stima errata della perdita di sangue è uno degli errori più frequenti che porta a un’EPP. Pertanto, sarebbe buona norma quantificare piuttosto che stimare. Quantificare la perdita di sangue è significativamente più accurato rispetto alla stima della perdita di sangue. Si è visto che la valutazione visiva della perdita sottostima di circa il 30-50% e che, al contrario, la quantificazione corretta riduce i ritardi nel trattamento. Si raccomanda di misurare la perdita di liquidi e sangue prima del parto e dopo, mediante sacche graduate e/o pesando la garza imbevuta di sangue e coaguli. Il peso di 1 grammo corrisponde a 1 mL di sangue.
Nella valutazione dell’EPP, può essere di aiuto orientarsi facendo riferimento alla “regola del 30”. Nel caso in cui si verifichino i seguenti eventi:
- pressione sistolica caduta di 30 mmHg
- frequenza cardiaca aumentata di 30/min
- frequenza respiratoria aumentata di 30/min
- emissione diuresi < 30 mL/ora
- Hb (Hct) diminuito del 30%
è probabile che la donna abbia perso il 30% del volume del sangue circolante, determinando un pannello di shock moderato.
Per valutare l’entità dello shock si può ricorrere allo shock index. Esso valuta il rapporto tra il battito cardiaco (heart rate, HR) e la pressione sanguigna sistolica (systolic blood pressure, sBP). Il rapporto HR/sBP è considerato normale per valori < 0,7. Quando il rapporto HR/sBP è > 1, indica shock severo e necessità di intervenire tempestivamente con una trasfusione (10).
Da studi recenti, è stato dimostrato come anche il sistema MEOWS (Modified Early Obstetric Warning System) sia uno strumento con buoni sensibilità, specificità e valore predittivo per predire la morbilità materna (Fig. 1) (11).
- Con 1 parametro giallo: ricontrollare i parametri nell’arco di 30-60 minuti.
- Con 2 parametri gialli e 1 rosso: far valutare la situazione a un dottore e ricontrollare i parametri ogni 30 minuti.
- Con più di 2 parametri gialli o più di 2 rossi: far valutare la situazione immediatamente a un medico e ricontrollare i parametri ogni 15 minuti.
Come detto in precedenza, un aspetto molto importante è la comunicazione interdisciplinare. Una comunicazione poco precisa e tempestiva può determinare effetti letali. Per facilitare la comunicazione interdisciplinare ci si può servire del modulo MEOWS multiparametrico come anche del pannello delle 4T.
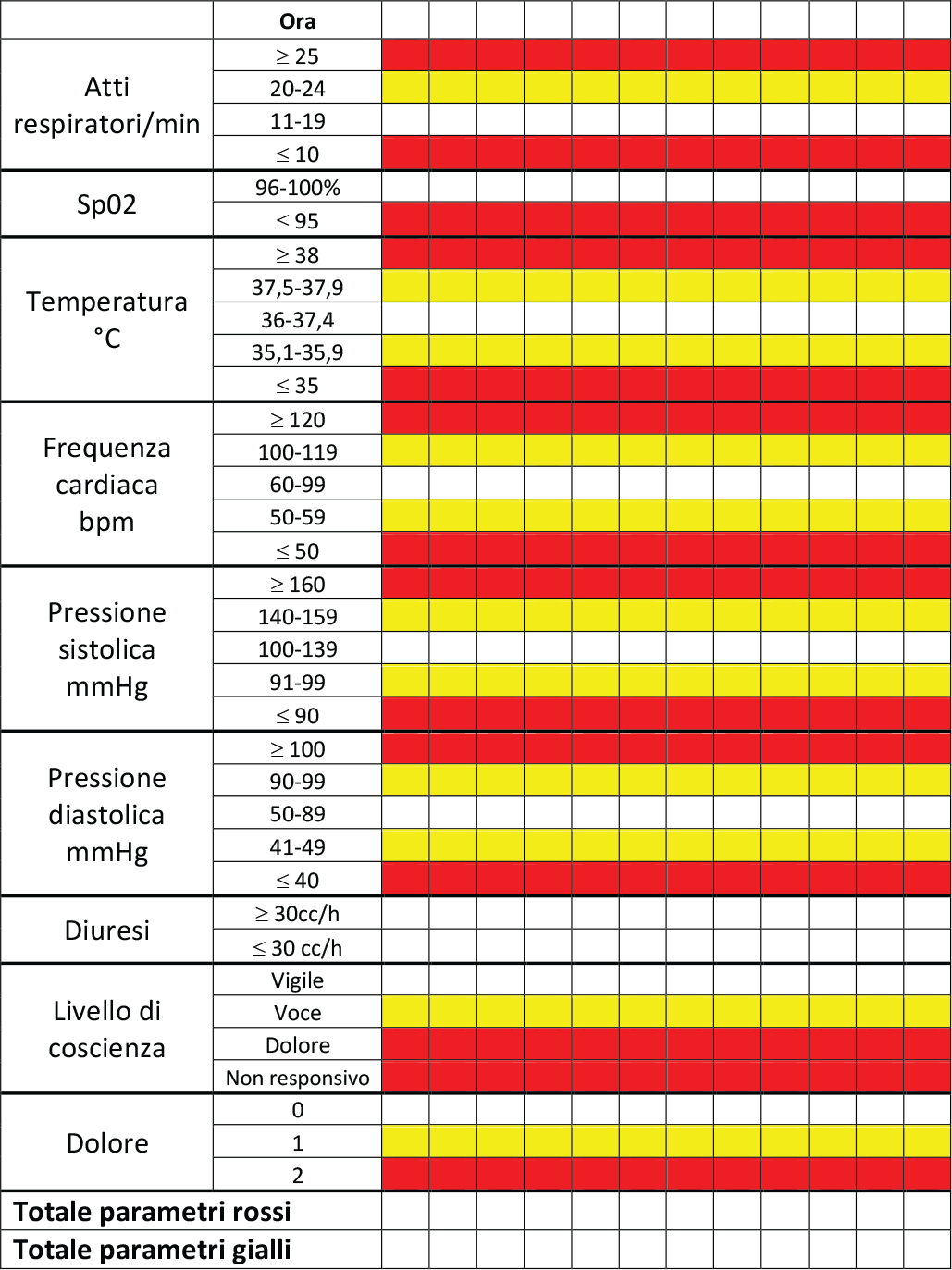
Fig. 1 - Parametri di osservazione MEOWS. SpO2: saturazione dell’ossigeno. Da (11) con il permesso dell’Editore.
Nei casi critici di EPP, è necessario chiedere la collaborazione di altre figure professionali, come ginecologo, seconda ostetrica, infermieri ed esperti anestesisti. Bisogna altresì allertare il centro trasfusionale, il laboratorio analisi, la sala operatoria, la chirurgia vascolare, la radiologia interventistica (dove disponibile) e coinvolgere sempre il personale più esperto.
Conclusioni
Negli ultimi anni, sono stati pubblicati diversi lavori per descrivere la gestione della trasfusione durante l’EPP e l’utilità dei test di laboratorio standard o point-of-care (POCT) per guidare la gestione dell’emostasi.
Se sono disponibili POCT, il monitoraggio della coagulazione può essere eseguito utilizzando i test viscoelastici ROTEM® o TEG®. Nelle Figure 2 e 3 sono mostrate la terapia guidata da ROTEM (Fig. 2) e la terapia guidata da TEG (Fig. 3) (12).
Sebbene gli algoritmi proposti non siano stati validati da trial o studi osservazionali, sono ugualmente utili nella pratica clinica. Da sottolineare sono l’importanza di un approccio multidisciplinare e la necessità di protocolli standardizzati e condivisi a supporto delle decisioni degli operatori sanitari.
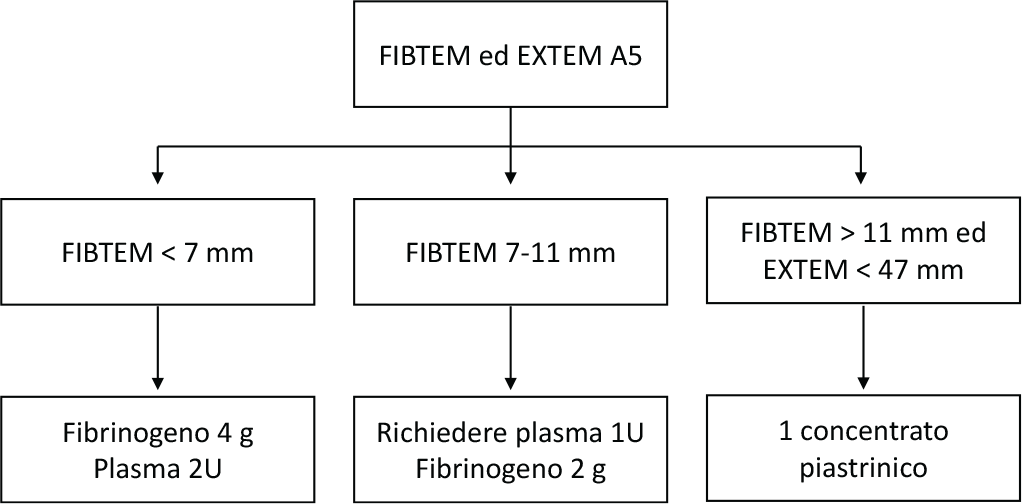
Fig. 2 - Terapia trasfusionale ROTEM-guidata. Da (12) con il permesso dell’Editore.
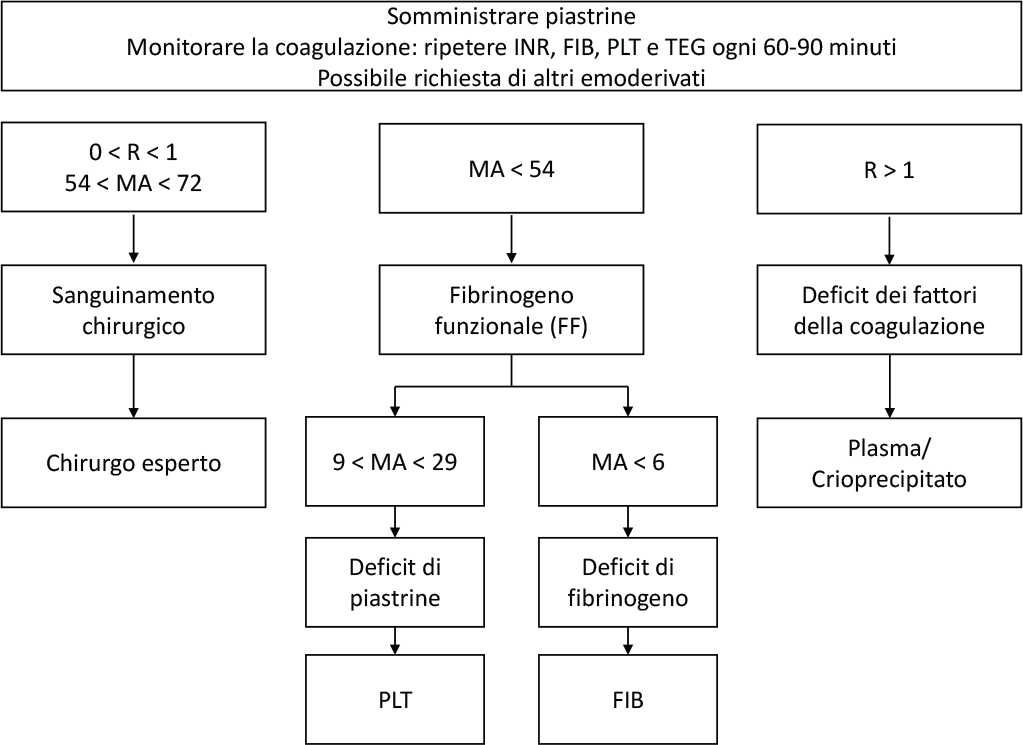
Fig. 3 - Terapia trasfusionale TEG-guidata. INR: International Normalised Ratio; aPTT: activated partial thromboplastin time; FIB: fibrinogen; PLT: platelets. Da (12) con il permesso dell’Editore.
Acknowledgements
We would like to thank Antonella Managò and Francesca La Rosa who, on behalf of Health Publishing & Services Srl, provided publishing support and journal styling services.
Disclosures
Conflict of interest: The author declares no conflict of interest.
Financial support: CSL Behring funded the publishing support and journal styling services. CSL Behring had no role in the conduct of the research, preparation of the article, in study design, in the collection, analysis and interpretation of data, in the writing of the report, and in the article for publication.
Bibliografia
- 1. Weeks A. The prevention and treatment of postpartum haemorrhage: what do we know, and where do we go to next? BJOG. 2015;122(2):202-210. CrossRef PubMed
- 2. Rath WH. Postpartum hemorrhage–update on problems of definitions and diagnosis. Acta Obstet Gynecol Scand. 2011;90(5):421-428. CrossRef PubMed
- 3. Geller SE, Rosenberg D, Cox SM, et al. The continuum of maternal morbidity and mortality: factors associated with severity. Am J Obstet Gynecol. 2004;191(3):939-944. CrossRef PubMed
- 4. Dilla AJ, Waters JH, Yazer MH. Clinical validation of risk stratification criteria for peripartum hemorrhage. Obstet Gynecol. 2013;122(1):120-126. CrossRef PubMed
- 5. Bateman BT, Berman MF, Riley LE, Leffert LR. The epidemiology of postpartum hemorrhage in a large, nationwide sample of deliveries. Anesth Analg. 2010;110(5):1368-1373. CrossRef PubMed
- 6. Mukherjee S, Arulkumaran S. Post-partum haemorrhage. Obstetrics, Gynaecol Reprod Med. 2009;19(5):121-126. CrossRef
- 7. Lancé MD. The management of critical bleeding in obstetrics. Rev Health Care. 2013;4(3S):41-51. CrossRef
- 8. Bissonnette J, Durand F, de Raucourt E, et al. Pregnancy and vascular liver disease. J Clin Exp Hepatol. 2015;5(1):41-50. CrossRef PubMed
- 9. Isbister JP. The three-pillar matrix of patient blood management–an overview. Best Pract Res Clin Anaesthesiol. 2013;27(1):69-84. CrossRef PubMed
- 10. Pacagnella RC, Souza JP, Durocher J, et al. A systematic review of the relationship between blood loss and clinical signs. PLoS One. 2013;8(3):e57594. CrossRef PubMed
- 11. Singh S, McGlennan A, England A, Simons R. A validation study of the CEMACH recommended modified early obstetric warning system (MEOWS). Anaesthesia. 2012;67(1):12-18. CrossRef PubMed
- 12. Frigo MG, Agostini V, Brizzi A, Ragusa A, Svelato A. Practical approach to transfusion management of post-partum haemorrhage. Transfus Med. 2021;31(1):11-15. CrossRef PubMed