 |
AboutOpen | 2022; 9: 77-82 ISSN 2465-2628 | DOI: 10.33393/ao.2022.2425 REVIEW |
 |
Gestione della coagulopatia indotta da trauma
Trauma-induced coagulopathy management
In the last years significant progress has been made in the understanding and treatment of hemorrhage caused by trauma which (along with the advances made in early resuscitation, and critical care) has led to a reduction of “late” deaths, meaning those due to trauma-induced organ failure/sepsis. Depending on the case, trauma is usually characterized by a variable equilibrium between hypo and hypercoagulation, with a majority of hypercoagulation cases. Trauma-induced coagulopathy (TIC), instead, is not only characterized by a coagulation disorder but also by a state of inflammation which increases the need for transfusions and the risk of multiorgan failure and thromboembolic complications. In this clinical picture, hemostatic resuscitation, damage control resuscitation and homeostasis maintenance have been shown to reduce mortality. According to guidelines, the heart of TIC treatment is an early individualised goal-directed treatment relying on coagulation support and thromboprophylactic strategies (administration of tranexamic acid, fibrinogen concentrate and packed red blood cells), platelet function monitoring and viscoelastic point-of-care testing. The implementation of the protocol suggested by the guidelines has allowed a more effective support of coagulopathy and has led to a reduction in hemoderivatives usage, hospitalization time and the death rate in severely injured trauma patients. The aforementioned improvements in TIC management were explicitly confirmed by a multicentric study in which the year the guidelines were implemented was compared with a prior year when no specific protocol was executed.
Keywords: Coagulation, Hemorrhage, Hemorrhagic shock, Practice guidelines, Trauma-induced coagulopathy
Received: May 19, 2022
Accepted: May 24, 2022
Published online: July 31, 2022
AboutOpen - ISSN 2465-2628 - www.aboutscience.eu/aboutopen
© 2022 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Il trauma, insieme all’emorragia ostetrica, può essere considerato un modello clinico di emorragia.
Negli ultimi decenni, i capisaldi sulle conoscenze riguardanti l’emorragia sono stati completamente rivisti e modificati. In uno studio del 2010 è stato infatti messo in evidenza come la mortalità da trauma, che è stata classicamente descritta con una distribuzione trimodale, i) decessi immediati sul posto, ii) morti precoci per emorragia, iii) morti tardive per insufficienza d’organo), sia contraddistinta in realtà da una distribuzione prevalentemente bimodale. Su 678 pazienti, i decessi sono stati classificati come immediati (al momento del trauma), precoci (in ospedale, ≤ 4 ore dall’infortunio) o tardivi (> 4 ore dopo l’infortunio). Le principali cause di sanguinamento sono state: grandi lacerazioni al cervello, al tronco cerebrale, all’aorta, al midollo spinale e al cuore, fratture pelviche, fratture delle ossa lunghe e lesioni addominali. I risultati hanno dimostrato che il 61% dei decessi era immediato, il 29% precoce e il 10% tardivo. Rispetto alla descrizione classica, la percentuale di decessi immediati è rimasta invariata, mentre i decessi precoci si sono verificati molto prima (mediana 52 vs 120 minuti). Tuttavia, il picco tardivo era notevolmente diminuito (1).
Questo dato riflette probabilmente avvenuti progressi nella rianimazione e nella terapia intensiva che hanno ridotto le morti per insufficienza d’organo post-trauma.
Lo shock emorragico rappresenta la seconda causa di morte prematura tra le persone che incorrono in un trauma. La percentuale maggiore di mortalità che si verifica entro la prima ora di cura nei centri traumatologici è causata da emorragia: oltre l’80% dei decessi in sala operatoria dopo un trauma maggiore e quasi il 50% dei decessi nelle prime 24 ore di cura del trauma (2,3).
Il trauma rappresenta un equilibrio variabile tra ipo- e ipercoagulazione: dopo un trauma, la risposta più comune è quella dell’ipercoagulazione necessaria per fronteggiare la situazione (l’80% dei profili, infatti, mostra uno stato di normoipercoagulazione). Tuttavia, vi sono situazioni in cui il paziente vittima di trauma maggiore presenta un quadro di ipocoagulazione con un’attivazione dei sistemi fibrinolitici e una disfunzione quali-quantitativa del fibrinogeno.
È stato stimato che il 25% dei traumatizzati arriva al Pronto Soccorso con parametri della coagulazione anomali (ipofibrinogenemia in particolare anche in assenza di una perdita significativa di sangue). Shock emorragico e coagulopatia si associano indipendentemente alla necessità di trasfusioni massicce e all’aumento della mortalità (4,5).
La coagulopatia trauma-indotta (TIC) è caratterizzata non soltanto da un disordine della coagulazione ma anche dell’infiammazione. È correlata a un aumento della necessità di trasfusione e della probabilità di insufficienza multiorgano e a una risposta infiammatoria e immunitaria; può inoltre scatenare complicanze tromboemboliche (6).
Il trauma tissutale e l’ipoperfusione sistemica sembrano essere i principali fattori responsabili dello sviluppo della coagulopatia traumatica acuta immediatamente dopo la lesione. Come risultato dell’attivazione della via della proteina C, la coagulopatia traumatica acuta è caratterizzata da coagulopatia in combinazione con iperfibrinolisi. Questa condizione può quindi essere esacerbata da successivi squilibri fisiologici e fisici come consumo di fattori della coagulazione, emodiluizione, ipotermia, acidemia e infiammazione, tutti fattori associati a emorragie in corso e a terapie rianimatorie o trasfusionali inadeguate. La conoscenza dei diversi meccanismi coinvolti nella patogenesi della coagulopatia traumatica acuta è essenziale per il successo della gestione dei pazienti con trauma emorragico. Le evidenze suggeriscono che il trattamento diretto alla rianimazione emostatica mirata (insieme a una strategia di Damage Control Resuscitation) può portare a riduzioni della mortalità dei pazienti gravemente feriti (7).
Nella fase acuta a seguito di un trauma, l’organismo tende all’iperfibrinolisi attraverso un meccanismo che coinvolge il complesso trombina-trombomodulina e proteina C attivata (aPC). Lesioni e ipoperfusione inducono un’eccessiva espressione di trombomodulina sulla parete cellulare endoteliale. A seguito di un’esplosione di trombina, quest’ultima si combina con la trombomodulina e il recettore della proteina C endoteliale (EPCR); il complesso così formatosi attiva la proteina C. La proteina C attivata (aPC) svolge probabilmente un ruolo essenziale inibendo i fattori V e VIII e l’inibitore dell’attivatore del plasminogeno (PAI) 1, causando uno stato ipocoagulativo e iperfibrinolitico (8).
Questi eventi portano a un potenziamento della fibrinolisi che, quando si innesca troppo rapidamente, può causare dei danni. Il 25-33% dei pazienti gravemente feriti ha elevati livelli di aPC, correlati a un aumentato rischio di trasfusioni e di mortalità (9).
Il livello critico dell’attività dei fattori della coagulazione in presenza di danno vascolare/tissutale è del 20-30%. La formazione di coaguli richiede la generazione di trombina a livello dei tessuti danneggiati e, sebbene i profili di formazione della trombina siano peculiari nella patologia traumatica con fenotipi sia emorragici che tromboembolici, la sua generazione nella TIC è sufficiente e i pazienti traumatizzati, con o senza TIC, mostrano evidenza di un aumento della trombina-antitrombina e dei frammenti di protrombina. Anche in questa condizione di lesione e shock, la generazione di trombina può aumentare a scapito della diminuzione dell’attività antitrombinica (10).
Un fattore importante al quale è necessario prestare attenzione è la temperatura corporea. Bisogna dare priorità a questo aspetto piuttosto che alla somministrazione dei fattori della coagulazione, in quanto su un paziente in ipotermia ogni tipo di intervento sarà inutile. Oltre che con le classiche strategie di riscaldamento (p. es., materassini, ambiente caldo), si può intervenire facilmente con dei cateteri per tenere caldi stomaco e vescica (50-100 cc di acqua a 36 °C).
Un ruolo centrale nel ritardare la formazione di trombina può essere ascritto alle piastrine (cell-based model of homeostasis). In un articolo del 2001 che tiene conto dello stato dell’arte sui meccanismi della coagulazione, viene proposta l’ipotesi che la coagulazione avvenga non come una “cascata”, bensì in tre fasi sovrapposte: 1) iniziazione, che si verifica su una cellula portatrice di fattori tissutali; 2) amplificazione, in cui vengono attivati piastrine e cofattori per preparare il terreno per la generazione di trombina su larga scala; 3) propagazione, in cui vengono generate grandi quantità di trombina sulla superficie delle piastrine. Questo modello spiega alcuni aspetti dell’emostasi che non sono tenuti in considerazione nel modello incentrato sulle proteine (11).
Per concludere, l’iperfibrinolisi è correlata a un alto tasso di mortalità e a trasfusioni massicce in caso di trauma e si osserva in meno del 20% dei pazienti con trauma grave. L’acido tranexamico, unico trattamento raccomandato, è stato associato a un basso rischio di sviluppare un tromboembolismo venoso dopo un trauma.
Linee Guida
Il trauma di base induce ipercoagulazione nell’organismo e necessita di fibrinogeno e cellule rosse che forniscono viscosità, quest’ultima funzionale alle piastrine per poter aderire bene alla superficie e per la formazione del trombo, fatto di fibrina, piastrine e globuli rossi.
La coagulopatia da trauma si può verificare a prescindere dal danno ricevuto. I progressi nella comprensione della fisiopatologia della coagulopatia post-traumatica hanno supportato strategie di gestione migliorate, inclusa l’evidenza che un trattamento precoce e individualizzato mirato migliora l’esito dei pazienti gravemente feriti.
Le Linee Guida europee sono state aggiornate al 2019 e per una consultazione completa si rimanda a “The European guideline on management of major bleeding and coagulopathy following trauma: fifth edition” (12).
Il cuore della terapia è il supporto precoce dell’emostasi intervenendo sul fibrinogeno e su un ripristino della massa ematica rossa. Se possibile, andrebbe preferito in generale il monitoraggio viscoelastico al fine di predisporre un trattamento goal-directed. Si raccomanda un valore target di emoglobina di 70/90 g/L.
Una novità introdotta dalle Linee Guida è la raccomandazione del monitoraggio della funzione piastrinica. Il platelet mapping del TEG 6s (test viscoelastico di monitoraggio della funzione piastrinica) fornisce un dato che riproduce quelli ottenuti con la citofluorimetria. Sono test nati per setting in cui si valuta l’effetto del metabolismo sui recettori dell’acido arachidonico e dell’ADP, ma il recettore dell’acido arachidonico, essendo coinvolto nell’infiammazione, è indirettamente una misura di come stiano funzionando le piastrine. Si stanno raccogliendo dati in questo senso nell’ambito della sepsi e si è visto che il TEG® ha una sensibilità e una specificità del 90% circa.
L’utilizzo di vasopressori e inotropi e il controllo del sito emorragico sono molto importanti.
Nella gestione iniziale dei pazienti con prevista emorragia massiva, si raccomanda inoltre una delle seguenti strategie: FFP o FFP pathogen-inactivated, in un rapporto FFP:RBC di almeno 1:2 secondo necessità.
In generale, le Linee Guida europee forniscono raccomandazioni che devono essere applicabili su tutti i setting, quindi non solo rivolte a centri che hanno a disposizione tecniche viscoelastiche ma anche a quelle realtà che non hanno la possibilità di capire con precisione cosa stia succedendo al paziente.
Il consiglio rimane di utilizzare farmaci piuttosto che derivati del sangue perché più precisi nella loro composizione, con profili di quantità e purezza del fattore certificati.
L’algoritmo “Early Coagulation Support (ECS)” suggerisce l’utilizzo precoce di fibrinogeno e di emazie concentrate e l’utilizzo del plasma solo ed esclusivamente in due condizioni: impossibilità di eseguire un test viscoelastico, quando la necessità trasfusionale supera le 4 unità di emazie concentrate; su indicazione del test viscoelastico una volta rimosse le condizioni che favoriscono un allungamento della fase enzimatica della coagulazione (ipotermia, acidosi, emodiluizione).
Algoritmi
Nei primi cinque minuti devono essere identificati i pazienti a rischio di coagulopatia e di emorragia. Ci si serve non solo dell’esame obiettivo del paziente ma anche di analisi da cui far derivare altri elementi fondamentali, come la valutazione dei seguenti fattori in presenza di un trauma che risponde alle caratteristiche del trauma maggiore (anche solo in presenza della dinamica):
evidenza di sanguinamento rilevabile su bilancio lesionale (p. es., frattura ossa lunghe) e/o alla primary survey con ECOFAST-E con almeno uno dei seguenti dati:
- emoglobina < 9 mg/dL
- pressione sistolica (SBP) shock < 100 mmHg
- acidosi < –6
- lattato > 5 mEq/L
Nella maggior parte dei casi il paziente con trauma arriva in ospedale in tempi mediamente brevi e si tratta di un paziente sano; se presenta, però, i dati sopraindicati deve essere trattato tempestivamente con una strategia di Damage Control Resuscitation (ipotensione permissiva, damage control surgery e rianimazione emostatica). La rianimazione emostatica comprende l’acido tranexamico, il fibrinogeno e le emazie.
Le cause che possono indurre un’alterazione dei lattati non devono essere necessariamente di tipo emorragico ma possono anche essere un’ipotensione e un’ipoperfusione. Nel caso in cui solo i lattati siano alterati, escludendo il problema emorragico, si può pensare che vi siano traumi spinali o crisi epilettiche in corso.
Questi elementi, esclusi i lattati, vengono valutati nel TASH Score (13).
Un TASH Score ≥ 15 è associato al 40% di trasfusioni massicce, a un alto Injury Severity Score (ISS, 42 ± 15,4) e al 40% di mortalità.
In uno studio del 2006 è stato osservato che l’ipotensione sistemica è un marker tardivo di shock e che, su pazienti ipotesi, la pressione sistolica o media non è correlata con l’eccesso basi ma l’eccesso basi sembra un dato più sensibile sull’ipoperfusione (14).
Un aspetto rimane dibattuto, ovvero quale sia il mezzo più efficace per prevenire la coagulopatia da trasfusione massiva, in assenza di studi controllati randomizzati. I test viscoelastici su sangue intero, come TEG® e ROTEM®, sembrano vantaggiosi per poterla identificare in pazienti con emorragia grave rispetto ai test di coagulazione convenzionali. I pazienti con sanguinamento incontrollato, indipendentemente dalla causa, dovrebbero essere trattati con una rianimazione di controllo emostatico che preveda la somministrazione precoce di emazie e fibrinogeno e di plasma e piastrine (quando indicati secondo le Linee Guida) nel più breve tempo possibile e mirata, sulla base dei risultati dell’analisi TEG®/ROTEM®. La goal directed therapy resa possibile dai test viscoelastici è associata a una ridotta mortalità (15).
Il protocollo ECS (Early Coagulation Support), un protocollo di intesa dell’Italian Trauma Update Research Group per la prevenzione e il trattamento della coagulopatia indotta dal trauma (TIC), include l’infusione tempestiva di acido tranexamico, di concentrato di fibrinogeno e di globuli rossi concentrati per la rianimazione iniziale dei pazienti con trauma maggiore.
L’utilizzo del protocollo ECS ha portato ai seguenti risultati (16):
- riduce il consumo di emoderivati e può essere adottato nella gestione dei pazienti con trauma maggiore;
- la sua applicazione, rispetto a una strategia basata sul plasma, è associata a una riduzione della degenza ospedaliera;
- prevede l’infusione precoce di acido tranexamico, concentrato di fibrinogeno e pRBC, invece di FFP, per il supporto precoce della coagulopatia;
- garantisce un supporto precoce della coagulazione nei pazienti con trauma maggiore e ad alto rischio emorragico.
Di seguito, tutti gli step (Fig. 1) (16):
se si riscontra anche solo uno degli elementi critici sopraelencati (p. es., sanguinamento: emoglobina < 9 mg/dL; pressione sistolica (SBP) shock < 100 mmHg; acidosi < –6; lattato > 5 mEq/L), si è di fronte a un trauma severo a rischio emorragico.
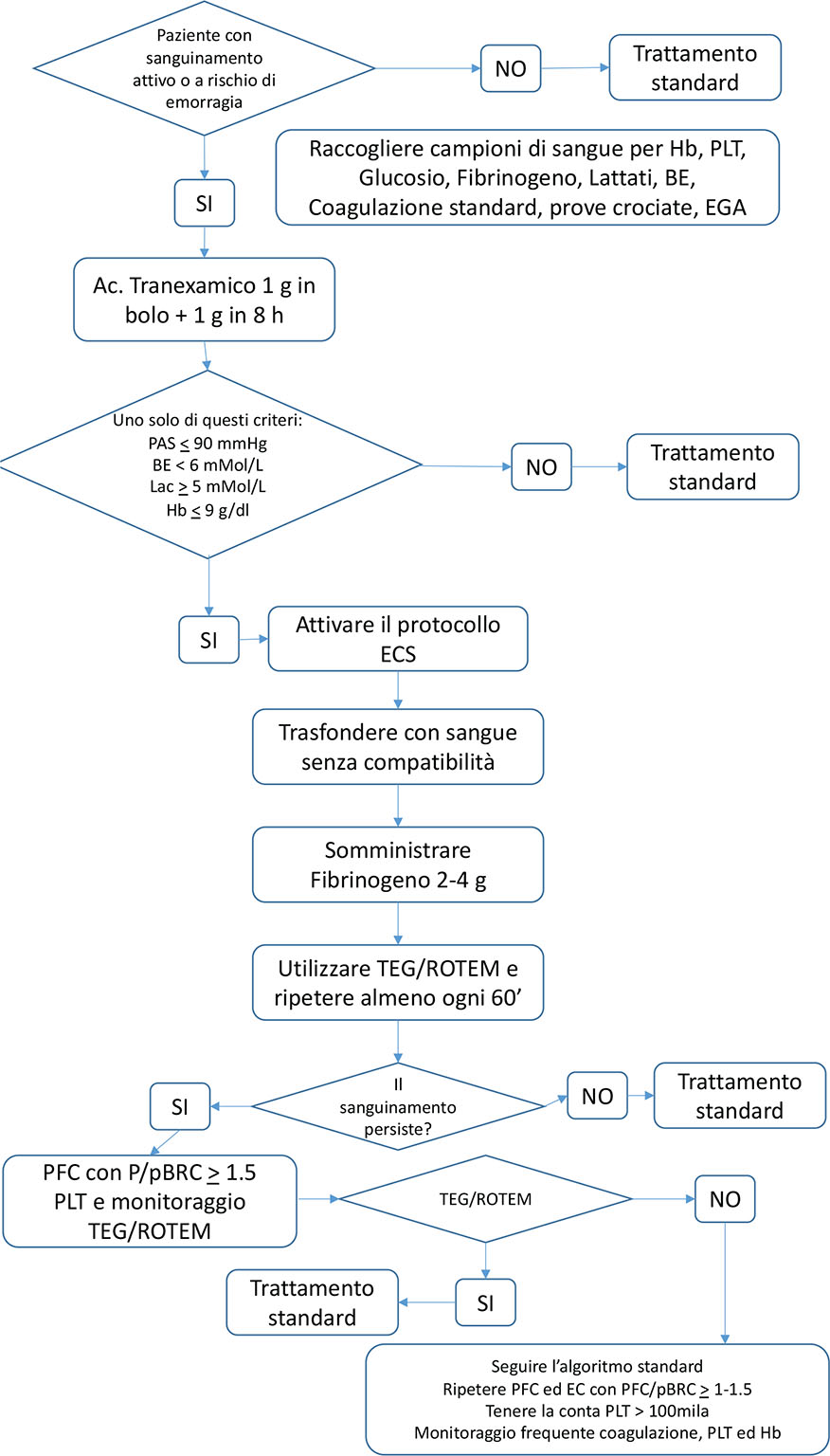
Fig. 1 - Protocollo ECS.
BE: base excess; ECS: early coagulation support; EGA: emogasanalisi; Hb: haemoglobin; P/pBRC: plasma/packed blood red cells; PAS: pressione arteriosa sistolica; PFC: plasma fresco congelato; PLT: platelets. Da (17) con il permesso dell’Editore.
Lo studio RETIC
Molto interessanti sono i risultati dello studio RETIC (Reversal of trauma-induced coagulopathy using first-line coagulation factor concentrates or fresh frozen plasma). Si è confrontata l’efficacia della terapia di prima linea, utilizzando FFP o concentrati di fattori della coagulazione (CFC), per l’inversione della coagulopatia indotta da trauma, i conseguenti requisiti trasfusionali e lo sviluppo di insufficienza multiorgano. Lo studio è stato interrotto per motivi di sicurezza a causa dell’elevata percentuale di pazienti, nel gruppo FFP, che richiedevano una terapia di salvataggio. Tuttavia, i risultati ottenuti sottolineano l’importanza di un’integrazione precoce ed efficace di fibrinogeno per gravi problemi di coagulazione in traumi multipli. La dimensione del campione disponibile sembra sufficiente per trarre alcune conclusioni secondo cui gli algoritmi basati su CFC, guidati dai test viscoelastici, sono superiori a quelli con FFP. Qui di seguito si riportano i dati per alcuni degli end point che sono stati valutati (17):
1) Multi organ failure (MOF, primary endpoint) [D: IN INGLESE]
• FFP: 29 pazienti (66%)
• CFC: 25 pazienti (50%)
• OR: 1,92 (p = 0,15)
2) Tempo necessario per la correzione della coagulopatia indotta da trauma e la normalizzazione del sanguinamento
• FFP: 128 min
• CFC: 22,5 min
• Diff.: 97 min (p < 0,0001)
3) Trasfusione massiva (> 10 RBC in 24 h):
• FFP: 13 pazienti (30%)
• CFC: 6 pazienti (12%)
• OR: 3,04 (p = 0,042)
Conclusioni
È stato condotto uno studio multicentrico di coorte per valutare l’impatto del protocollo di supporto alla coagulazione precoce (ECS) sul consumo di emoderivati, sulla mortalità e sui costi di trattamento. Sono stati raccolti prospetticamente i dati di pazienti gravemente feriti (Injury Severity Score (ISS) > 15) ammessi in due centri traumatologici nel 2013 e questi risultati sono stati confrontati con i dati del 2011. Nello studio sono stati inclusi pazienti trasfusi con almeno 3 unità di globuli rossi concentrati (pRBC) entro 24 ore da un incidente. Nel 2011, i pazienti con emorragia significativa sono stati trattati con la somministrazione precoce di plasma con l’obiettivo di raggiungere un rapporto plasma/pRBC elevato (≥ 1:2). Nel 2013, la strategia di trattamento è stata invece il protocollo ECS (18).
Per quanto riguarda i risultati ottenuti, nel 2013 è stata osservata una riduzione complessiva del 40% dei pRBC, insieme a una diminuzione del 65% del plasma e del 52% delle piastrine. I pazienti nel gruppo ECS hanno ricevuto meno quantità di emoderivati: 6,51 unità di pRBC contro 8,14 unità. Le trasfusioni di plasma sono diminuite da 8,98 unità a 4,21 unità (p < 0,05) e le piastrine da 4,14 unità a 2,53 unità (p < 0,05).
La mortalità nel 2013 è stata del 13,5% contro il 20% nel 2011 (rispettivamente 13 vs 26 decessi ospedalieri, dato non significativo). Confrontando i costi per emocomponenti, fattori e test point-of-care, è stato registrato un risparmio di € 76.340 rispetto al 2011. In conclusione, l’introduzione del protocollo ECS in due centri traumatologici italiani è stata associata a una marcata riduzione del consumo di emoderivati. I costi complessivi per il supporto trasfusionale e coagulativo (compresi i test point-of-care) sono diminuiti del 23% tra il 2011 e il 2013 (18).
Acknowledgements
We would like to thank Antonella Managò and Francesca La Rosa who, on behalf of Health Publishing & Services Srl, provided publishing support and journal styling services.
Disclosures
Conflict of interest: The author declares no conflict of interest.
Financial support: CSL Behring funded the publishing support and journal styling services. CSL Behring had no role in the conduct of the research, preparation of the article, in study design, in the collection, analysis and interpretation of data, in the writing of the report, and in the article for publication.
Bibliografia
- 1. Gunst M, Ghaemmaghami V, Gruszecki A, Urban J, Frankel H, Shafi S. Changing epidemiology of trauma deaths leads to a bimodal distribution. Proc Bayl Univ Med Cent. 2010;23(4):349-354. CrossRef PubMed
- 2. Kauvar DS, Lefering R, Wade CE. Impact of hemorrhage on trauma outcome: an overview of epidemiology, clinical presentations, and therapeutic considerations. J Trauma. 2006;60(6)(suppl):S3-S11. CrossRef PubMed
- 3. Savioli G, Ceresa IF, Caneva L, Gerosa S, Ricevuti G. Trauma-Induced Coagulopathy: Overview of an Emerging Medical Problem from Pathophysiology to Outcomes. Medicines (Basel). 2021;8(4):16. CrossRef PubMed
- 4. Brohi K, Cohen MJ, Davenport RA. Acute coagulopathy of trauma: mechanism, identification and effect. Curr Opin Crit Care. 2007;13(6):680-685. CrossRef PubMed
- 5. Brohi K, Singh J, Heron M, Coats T. Acute traumatic coagulopathy. J Trauma. 2003;54(6):1127-1130. CrossRef PubMed
- 6. Cohen MJ, Call M, Nelson M, et al. Critical role of activated protein C in early coagulopathy and later organ failure, infection and death in trauma patients. Ann Surg. 2012;255(2):379-385. CrossRef PubMed
- 7. Ganter MT, Pittet JF. New insights into acute coagulopathy in trauma patients. Baillieres Best Pract Res Clin Anaesthesiol. 2010;24(1):15-25. CrossRef PubMed
- 8. Thorsen K, Ringdal KG, Strand K, Søreide E, Hagemo J, Søreide K. Clinical and cellular effects of hypothermia, acidosis and coagulopathy in major injury. Br J Surg. 2011;98(7):894-907. CrossRef PubMed
- 9. Kornblith LZ, Moore HB, Cohen MJ. Trauma-induced coagulopathy: the past, present, and future. J Thromb Haemost. 2019;17(6):852-862. CrossRef PubMed
- 10. Cardenas JC, Rahbar E, Pommerening MJ, et al. Measuring thrombin generation as a tool for predicting hemostatic potential and transfusion requirements following trauma. J Trauma Acute Care Surg. 2014;77(6):839-845. CrossRef PubMed
- 11. Hoffman M, Monroe DM III. A cell-based model of hemostasis. Thromb Haemost. 2001;85(6):958-965. CrossRef PubMed
- 12. Spahn DR, Bouillon B, Cerny V, et al. The European guideline on management of major bleeding and coagulopathy following trauma: fifth edition. Crit Care. 2019 Mar 27;23(1):98. CrossRef PubMed
- 13. Yücel N, Lefering R, Maegele M, et al; Polytrauma Study Group of the German Trauma Society. Trauma Associated Severe Hemorrhage (TASH)-Score: probability of mass transfusion as surrogate for life threatening hemorrhage after multiple trauma. J Trauma. 2006;60(6):1228-1236. CrossRef PubMed
- 14. Parks JK, Elliott AC, Gentilello LM, Shafi S. Systemic hypotension is a late marker of shock after trauma: a validation study of Advanced Trauma Life Support principles in a large national sample. Am J Surg. 2006;192(6):727-731. CrossRef PubMed
- 15. Johansson PI, Stensballe J, Ostrowski SR. Current management of massive hemorrhage in trauma. Scand J Trauma Resusc Emerg Med. 2012;20(20):47. CrossRef PubMed
- 16. Bocci MG, Nardi G, Veronesi G, et al. Early coagulation support protocol: A valid approach in real-life management of major trauma patients. Results from two Italian centres. Injury. 2019;50(10):1671-1677. CrossRef PubMed
- 17. Innerhofer P, Fries D, Mittermayr M, et al. Reversal of trauma-induced coagulopathy using first-line coagulation factor concentrates or fresh frozen plasma (RETIC): a single-centre, parallel-group, open-label, randomised trial. Lancet Haematol. 2017;4(6):e258-e271. CrossRef PubMed
- 18. Nardi G, Agostini V, Rondinelli B, et al. Trauma-induced coagulopathy: impact of the early coagulation support protocol on blood product consumption, mortality and costs. Crit Care. 2015;19(1):83. CrossRef PubMed