 |
AboutOpen | 2022; 9: 36-41 ISSN 2465-2628 | DOI: 10.33393/ao.2022.2405 ORIGINAL RESEARCH ARTICLE |
 |
Analisi del costo di trattamento di rurioctocog alfa pegol rispetto a turoctocog alfa pegol nella terapia di profilassi dell’emofilia A in Italia
ABSTRACT
Cost analysis comparison of rurioctocog alfa pegol compared to turoctocog alfa pegol in the prophylaxis of Haemophilia A in Italy
Background: Hemophilia-A is an X-linked genetic disorder arising from a mutation to the X chromosome and causing either a quantitative or qualitative deficiency in blood clotting factor-VIII (FVIII). Several recombinant extended half-life FVIII products (rFVIII-EHL) are in use in Italy for the treatment of hemophilia-A.
Objective: To estimate the annual average cost of the prophylactic treatment of a patient with hemophilia-A in Italy with rurioctocog alfa pegol or turoctocog alfa pegol, with particular regard to potential dose adjustments as provided in the SPCs.
Methods: The comparison between the two rFVIII-EHL, expressed in terms of average annual cost per patient treated, was conducted from the NHS perspective. The average annual consumption (IU/kg) of the two rFVIII-EHL was derived from the clinical trial of reference for in label prophylactic treatment. Adjustments of doses and administration intervals allowed in the SPCs were considered on the basis of the literature. The published ex-factory price considered for both rFVIII-EHL was € 0.72. A scenario analysis focused on possible dosing adjustments was conducted.
Results: With regard to the average consumption associated with the posology in label, the average annual treatment cost is almost the same between the two rFVIII-EHL. Whereas taking into account the possible dose adjustments based on once-weekly administration, rurioctocog alfa pegol shows a considerably lower average annual treatment cost compared to turoctocog alfa pegol (– € 42,719).
Conclusions: Rurioctocog alfa pegol would be the more sustainable option, based on the annual average cost, for the NHS in the prophylactic treatment of hemophilia-A.
Keywords: Cost, Hemophilia A, Once-weekly, Prophylaxis, Rurioctocog alfa pegol, Turoctocog alfa pegol
Received: March 25, 2022
Accepted: May 6, 2022
Published online: June 6, 2022
AboutOpen - ISSN 2465-2628 - www.aboutscience.eu/aboutopen
© 2022 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
L’emofilia A è determinata da una mutazione del cromosoma X (X-linked) che causa un deficit quantitativo o qualitativo del fattore VIII (FVIII) della coagulazione (1). Secondo i più recenti dati epidemiologici, l’incidenza dell’emofilia A si attesta a circa 1 caso ogni 5.000 maschi (1-3), mentre la prevalenza sembrerebbe variare da Paese a Paese in un range compreso tra i 5,4 e i 14,5 casi ogni 100.000 maschi (2). In relazione ai livelli circolanti plasmatici residui del FVIII, l’emofilia A può essere classificata in lieve (FVIII da 6 a 40 UI/dL), moderata (FVIII da 1 a 5 UI/dL) e grave (FVIII inferiore a 1 UI/dL) (1,2,4). La gravità dei sintomi emorragici è correlata al grado di carenza del FVIII (5,6) e le manifestazioni emorragiche più frequenti sono: emartri nel 70-80% dei casi (le sedi più colpite sono ginocchio, gomito e caviglia), ematomi muscolari nel 10-20% dei casi e altre emorragie maggiori nel 5-10% dei casi (6). Gli episodi emorragici possono essere “spontanei” nelle forme gravi e in misura minore nelle forme moderate, mentre, nella maggior parte dei casi, nelle forme lievi gli episodi emorragici sono successivi a traumi (1,2,4). La maggior parte dei trattamenti dell’emofilia A si basa su una terapia sostitutiva con concentrati del FVIII per bilanciarne i livelli circolanti plasmatici (1,2). Il concentrato del FVIII può essere plasmaderivato, ovvero di derivazione plasmatica, oppure ricombinante, ovvero di derivazione sintetica, realizzato con tecniche di ingegneria genetica (1). La complicazione principale della terapia sostitutiva è la comparsa di anticorpi diretti contro il fattore FVIII detti “inibitori”, che ne neutralizzano l’effetto e che possono rendere difficile la terapia (7). Attualmente sono disponibili due strategie terapeutiche per il trattamento dell’emofilia A: la terapia “on demand” e la profilassi (1,2,4). La terapia “on demand”, generalmente adottata nelle forme lievi o moderate, consiste nel trattamento ad hoc di un evento emorragico causato, per esempio, da un trauma oppure in previsione di eventi come le operazioni chirurgiche (1,2,4). La profilassi, che rappresenta invece lo standard of care nella forma grave, prevede la somministrazione a lungo termine del FVIII al fine di evitare sanguinamenti/emorragie (1,2,4). Fino all’avvento dei nuovi concentrati del FVIII a emivita estesa, la profilassi dell’emofilia A con la terapia sostitutiva era solitamente caratterizzata da frequenti somministrazioni endovenose (a giorni alterni o tre volte alla settimana) del FVIII a causa della sua breve emivita (circa 12 ore) (8). L’elevata frequenza di queste somministrazioni rappresenta un onere sia per i pazienti sia per i caregiver. Il successivo sviluppo dei farmaci ricombinanti a emivita estesa ha però permesso di migliorare la gestione della terapia di profilassi nei soggetti con emofilia A, consentendo una riduzione della frequenza delle somministrazioni e un aumento dell’aderenza al trattamento. Oggi in Italia sono utilizzati diversi FVIII ricombinanti a emivita estesa (rFVIII-EHL) per il trattamento dell’emofilia A tra cui turoctocog alfa pegol, ultimo a essere stato rimborsato dal Servizio Sanitario Nazionale (SSN) (9-12). Attualmente non sono disponibili evidenze locali che, dopo il rimborso ottenuto da turoctocog alfa pegol, abbiano comparato in modo diretto rurioctocog alfa pegol e turoctocog alfa pegol. Le due alternative, infatti, sembrano particolarmente adatte per essere messe a confronto, in quanto sono le uniche, all’interno della classe degli EHL, a riportare, nei rispettivi riassunti delle caratteristiche del prodotto (RCP) (11,12), una definizione sovrapponibile per i possibili dosaggi consentiti. Per entrambi i principi attivi, è specificato che possono essere considerati aggiustamenti della dose e degli intervalli di somministrazione sulla base dei livelli di fattore VIII e della tendenza individuale al sanguinamento. L’analisi è stata condotta con l’obiettivo di stimare il costo medio annuo di trattamento di profilassi con rurioctocog alfa pegol o turoctocog alfa pegol per un paziente con emofilia A in Italia, con particolare riferimento a eventuali aggiustamenti di dosaggio previsti nel RCP.
Metodi
Premessa
Il confronto tra i due rFVIII-EHL, espresso in termini di costo medio annuo per paziente trattato, è stato condotto in base alla prospettiva del SSN. Nello specifico l’analisi si è focalizzata sui soli costi differenzianti le due alternative, vale a dire sui costi farmacologici associati all’utilizzo dei due rFVIII-EHL. La stima dei costi è riferita all’anno 2021, mentre l’orizzonte temporale dell’analisi è stato posto pari a 52 settimane (1 anno), commisurato all’obiettivo di stimare un costo medio annuo per paziente. La Tabella I riporta nel dettaglio l’indicazione e gli schemi posologici per la profilassi a lungo termine di rurioctocog alfa pegol e turoctocog alfa pegol (11,12).
Schema di somministrazione
La stima del consumo medio annuo (UI/kg) dei due rFVIII-EHL è stata effettuata sulla base del dosaggio medio per chilogrammo (kg) e del numero medio di somministrazioni settimanali desumibili dagli schemi di somministrazione riportati nei rispettivi studi registrativi di riferimento (11-14). Dal momento che il dosaggio di somministrazione dei due rFVIII-EHL è peso dipendente, i rispettivi consumi medi annui sono stati calcolati considerando, come convenzione, un paziente adulto di peso medio corporeo di 70 kg (15). Come indicato nei RCP (11,12), sulla base di quanto presente in letteratura sono stati considerati anche eventuali aggiustamenti delle dosi o delle frequenze di somministrazione (16-18). La Tabella II riporta in dettaglio gli schemi di somministrazione considerati nella presente analisi per i due rFVIII-EHL considerati.
Il RCP di rurioctocog alfa pegol riporta per la profilassi a lungo termine una dose raccomandata di 40-50 UI/kg somministrata due volte alla settimana con intervalli di 3-4 giorni (11). Nell’analisi sono stati considerati una dose media di 44,6 UI/kg e un numero medio di somministrazioni/settimana di 1,96 (6.119 UI/settimana) (Tab. II). Viene inoltre indicata la possibilità di effettuare aggiustamenti delle dosi e degli intervalli tra le somministrazioni in considerazione dei livelli di FVIII raggiunti e della predisposizione individuale al sanguinamento (11). Facendo riferimento a quanto riportato nello studio clinico condotto da Chowdary et al. (16,18), i pazienti in trattamento con rurioctocog alfa pegol che non manifestano sanguinamenti spontanei per 6 mesi dall’inizio del trattamento potrebbero passare al regime che prevede la somministrazione ogni 5 giorni e successivamente passare al regime che prevede la somministrazione ogni 7 giorni se continuano a non avere sanguinamenti spontanei per altri 6 mesi. Nell’analisi sono stati quindi considerati due ulteriori schemi posologici che prevedono un aggiustamento della posologia con una dose media di 55,2 UI/kg somministrati in media 1,3 volte alla settimana (5.019 UI/settimana) oppure ogni 7 giorni (1 volta alla settimana) (4.263 UI/settimana) (Tab. II).
| Nome commerciale | Composizione | Indicazione | Posologia per la profilassi a lungo termine |
|---|---|---|---|
| Rurioctocog alfa pegol (11)* | Il principio attivo rurioctocog alfa pegol è un coniugato covalente della proteina octocog alfa con un polietilenglicole da 20 kDa (PEG). | Trattamento e profilassi del sanguinamento in pazienti dai 12 anni in poi affetti da emofilia A (deficit congenito di fattore VIII). | La dose raccomandata è di 40-50 UI di rurioctocog alfa pegol per chilogrammo di peso corporeo due volte alla settimana con intervalli di 3-4 giorni. Aggiustamenti delle dosi e degli intervalli tra le somministrazioni possono essere presi in considerazione sulla base dei livelli di FVIII raggiunti e della predisposizione individuale al sanguinamento. |
| Turoctocog alfa pegol (12)** | Il principio attivo turoctocog alfa pegol è un coniugato covalente della proteina turoctocog alfa con un polietilenglicole (PEG) da 40 kDa. | Trattamento e profilassi di episodi emorragici in pazienti a partire da 12 anni affetti da emofilia A (deficit congenito di fattore VIII). | La dose raccomandata è di 50 UI di turoctocog alfa pegol per kg di peso corporeo ogni 4 giorni.
Aggiustamenti della dose e intervalli di somministrazione possono essere considerati sulla base dei livelli di fattore VIII e della tendenza individuale al sanguinamento. |
*Fattore VIII umano prodotto mediante la tecnologia del DNA ricombinante in una linea cellulare di ovaio di criceto cinese (Chinese Hamster Ovary, CHO).
**Fattore VIII umano, prodotto con la tecnologia del DNA ricombinante in linea cellulare di ovaio di criceto cinese (CHO) e nella coltura cellulare, purificazione, coniugazione o formulazione di Turoctocog alfa pegol non sono utilizzati additivi di origine umana o animale.
Il RCP di turoctocog alfa pegol riporta per la profilassi a lungo termine una dose raccomandata di 50 UI/kg di peso corporeo somministrata ogni 4 giorni (Tab. II) (12). Nell’analisi, è stata considerata una dose media di 52,2 UI/kg somministrata 1,71 volte alla settimana (6.239 UI/settimana) (12). Possono essere inoltre considerati possibili aggiustamenti della dose e intervalli di somministrazione sulla base dei livelli di fattore VIII e della tendenza individuale al sanguinamento (12). Nella Tabella II, facendo riferimento a quanto riportato nello studio clinico condotto da Curry et al. (17), è stato considerato un aggiustamento dello schema di somministrazione che prevede un dosaggio medio di 77,2 UI/kg somministrato un’unica volta alla settimana (5.404 UI/kg/settimana).
Prezzo di acquisto dei rFVIII-EHL
La valorizzazione dei consumi associati ai differenti schemi di somministrazione considerati per rurioctocog alfa pegol o per turoctocog alfa pegol è avvenuta moltiplicando il numero medio di UI/kg/anno (Tab. II) per i rispettivi prezzi ex-factory per UI (IVA esclusa) al lordo di eventuali sconti negoziali non riportati nelle corrispondenti gazzette ufficiali (19,20). Indipendentemente dalla confezione considerata, per entrambi i rFVIII-EHL è stato considerato un prezzo ex-factory di € 0,72 per UI.
Analisi di scenario
Al fine di rendere uniformi i confronti, dall’analisi di scenario è stato escluso lo schema posologico che prevede le somministrazioni di rurioctocog alfa pegol ogni 5 giorni. L’analisi di scenario è stata condotta per valutare eventuali possibili variazioni dei prezzi dei due rFVIII-EHL. Quello considerato nel caso base dell’analisi, infatti, potrebbe non riflettere l’attuale prezzo di cessione al SSN dei due rFVIII-EHL, in quanto le Gazzette Ufficiali dei due prodotti riportano sconti obbligatori sul prezzo ex-factory (non visibili), da praticare alle strutture sanitarie pubbliche (19,20). L’obiettivo è stato, quindi, stimare l’impatto di alcune ipotesi di sconto relative al prezzo di rurioctocog alfa pegol e di turoctocog alfa pegol sui costi medi annui di trattamento. Nello specifico, non essendo disponibili gli effettivi sconti negoziati, è stato ipotizzato che per entrambi i rFVIII-EHL il valore degli sconti negoziali possa raggiungere un valore massimo del 35% (range 0%-35%) (21). Tramite una tabella a matrice sono state valutate tutte le combinazioni di possibili sconti associati al costo medio annuo di trattamento per i due rFVIII-EHL.
Risultati
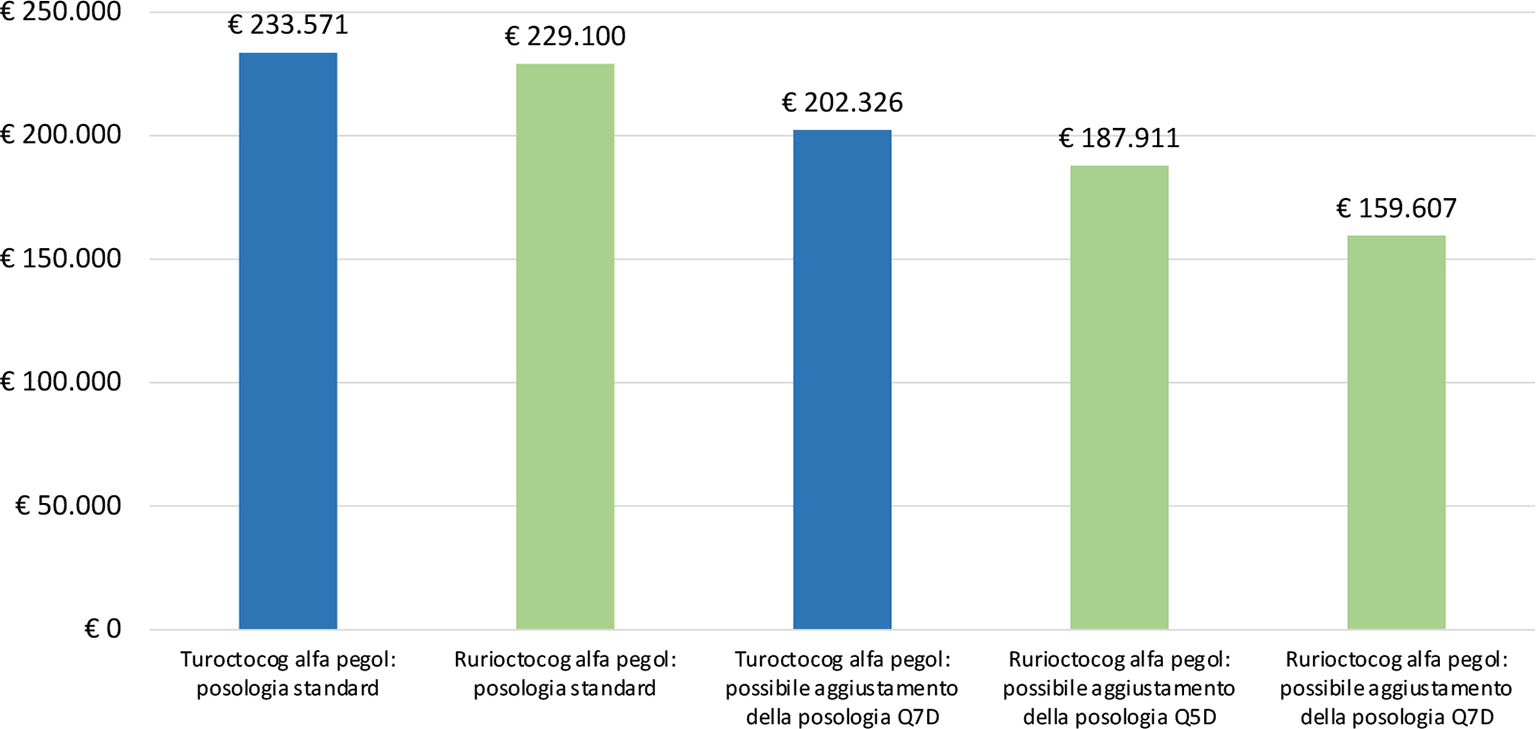
Se si considera la posologia media da RCP (11,12), il consumo medio annuo è simile per i due rFVIII-EHL, con una differenza di 6.210 UI (rurioctocog alfa pegol: 318.194 UI; turoctocog alfa pegol: 324.404 UI). Se invece si sposta l’attenzione sui consumi associati ai possibili aggiustamenti della posologia media (16-18), rurioctocog alfa pegol evidenzia una sensibile riduzione del consumo medio annuo rispetto a turoctocog alfa pegol, compresa nel range 20.020 UI-59.332 UI (rurioctocog alfa pegol ogni 5 giorni: 260.988 UI; rurioctocog alfa pegol ogni 7 giorni: 221.676 UI; turoctocog alfa pegol ogni 7 giorni: 281.008 UI). La Figura 1 riporta per ognuno dei due rFVIII-EHL i relativi costi medi annui di trattamento calcolati sulla base degli schemi di somministrazione raccomandati dai RCP (11,12) o di quelli che prevedono un aggiustamento della posologia (16,17) e dei prezzi ex-factory. Rispetto alla posologia media da RCP (11,12), il costo medio annuo di trattamento di rurioctocog alfa pegol è di € 229.100 e quello di turoctocog alfa pegol di € 233.571, con un risparmio associato a rurioctocog alfa pegol di € 4.471. Se invece si considerano i possibili aggiustamenti della posologia media che prevedono una somministrazione ogni 7 giorni (1 volta alla settimana) (16,17), rurioctocog alfa pegol evidenzia un costo medio annuo di trattamento sensibilmente inferiore a quello di turoctocog alfa pegol, generando un risparmio di € 42.719 (Fig. 1).
| rFVIII-EHL | UI/Kg medi per somm. | Somm./sett. | UI/Kg/sett. | UI/Kg/anno |
|---|---|---|---|---|
| Rurioctocog alfa pegol | ||||
| Posologia da RCP (11): 40-50 UI/kg due volte alla settimana | 44,6 | 1,96 | 6.119 | 318.194 |
| Aggiustamento posologia (13): 40-50 UI/kg ogni 5 giorni | 55,2 | 1,30 | 5.019 | 260.988 |
| Aggiustamento posologia (13): 40-50 UI/kg ogni 7 giorni | 60,9 | 1,00 | 4.263 | 221.676 |
| Turoctocog alfa pegol | ||||
| Posologia da RCP (12): 50 UI/kg ogni 4 giorni | 52,2 | 1,71 | 6.239 | 324.404 |
| Aggiustamento posologia (14): 75 UI/kg ogni 7 giorni | 77,2 | 1,00 | 5.404 | 281.008 |
*Il calcolo del dosaggio è stato effettuato considerando un paziente adulto di peso medio pari a 70 Kg e l’anno composto da 52 settimane. Somm. = somministrazioni. Sett. = settimane.
Analisi di scenario
La Tabella III riporta i risultati dell’analisi di scenario condotta per i due rFVIII-EHL in relazione agli schemi posologici che prevedono una somministrazione ogni 7 giorni (1 volta alla settimana). Considerando quindi tutte le possibili combinazioni di sconto, la probabilità che il costo medio annuo di trattamento di rurioctocog alfa pegol sia inferiore a quello di turoctocog alfa pegol è dell’89,5%.
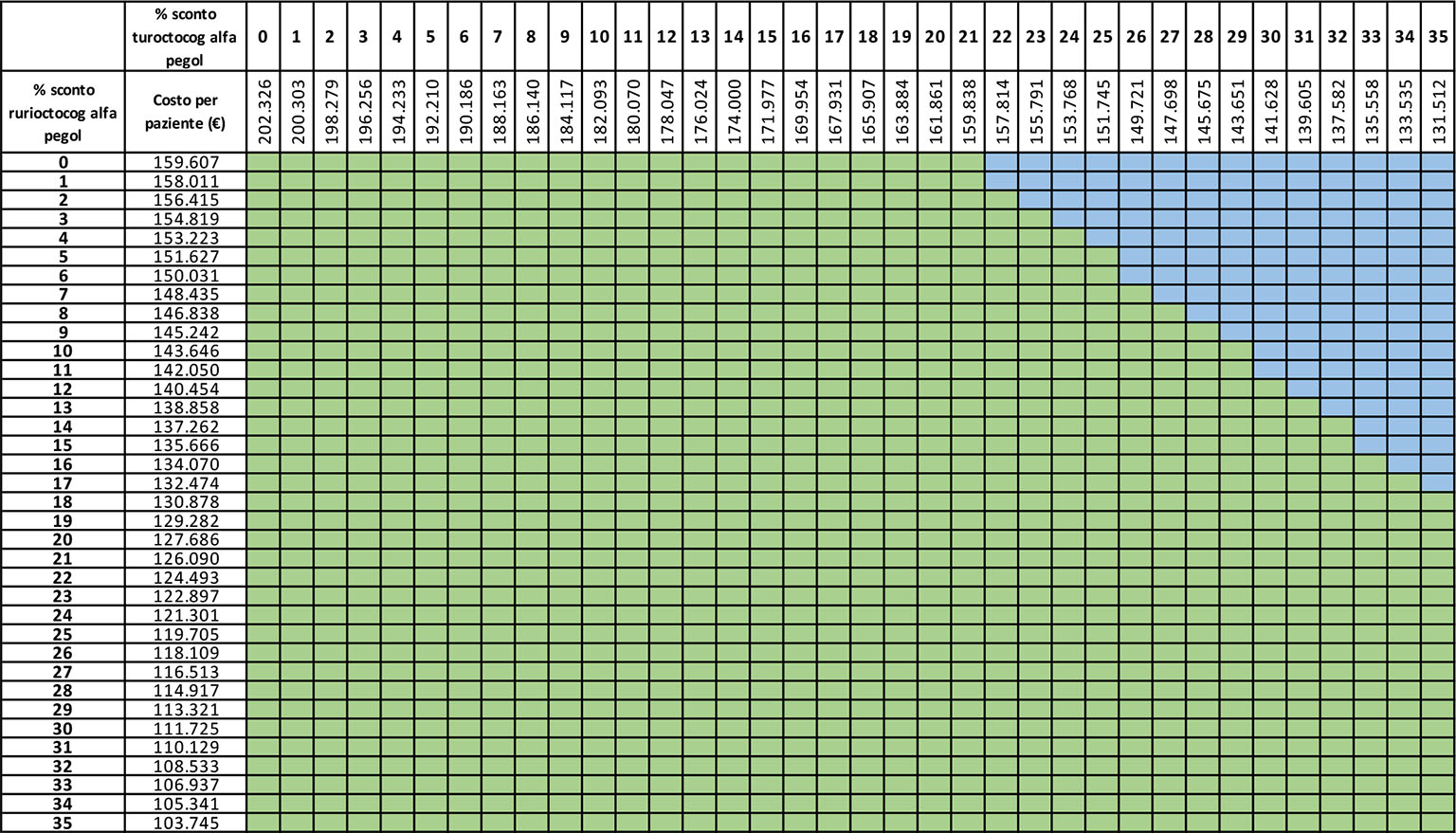
Legenda: verde = costo medio annuo di trattamento di rurioctocog alfa pegol < costo medio annuo di trattamento turoctocog alfa pegol; azzurro = costo medio annuo di trattamento di rurioctocog alfa pegol > costo medio annuo di trattamento turoctocog alfa pegol.
Discussione
Con l’introduzione del fattore VIII umano derivato dal plasma e successivamente ricombinante ai pazienti affetti da emofilia A è stata data l’opportunità di avere una qualità e un’aspettativa di vita simili alla popolazione generale (22-23) [A: confermare che ref 22 sia corretta in questa posizione]. Insieme all’efficacia clinica, la riduzione della frequenza delle somministrazioni del rFVIII rappresenta uno degli elementi più frequentemente riportati in termini di soddisfazione del trattamento per i pazienti con emofilia A (24,25). Somministrazioni meno frequenti sono infatti associate a benefici in termini di Health Related Quality of Life (HRQoL), come minor tempo impiegato per programmare ed effettuare le somministrazioni e benefici emotivi e fisici (24,25). I nuovi rFVIII-EHL, essendo caratterizzati da un numero ridotto di somministrazioni, sembrano quindi avere il potenziale per modificare gli schemi di trattamento per la profilassi dei pazienti con emofilia A, favorendone la compliance. Infatti, i rFVIII-EHL sono in grado di rispondere a un bisogno clinico insoddisfatto determinato dall’elevata frequenza delle somministrazioni e dal conseguente impatto sulla vita quotidiana. Rurioctocog alfa pegol e turoctocog alfa pegol hanno dimostrato un buon profilo di efficacia e di sicurezza nel trattamento di pazienti affetti da emofilia A con età ≥ 12 anni (13,14,16,17). Considerando i dosaggi medi e il numero medio di somministrazioni settimanali riportati nei rispettivi RCP (11,12), sia il costo medio annuo di trattamento sia il consumo medio annuo (UI) risultano simili per i due rFVIII-EHL considerati. Ponendo invece l’attenzione sull’analisi relativa ai possibili aggiustamenti della posologia che prevedono per i due rFVIII-EHL una somministrazione ogni sette giorni (16-18) e utilizzando per rurioctocog alfa pegol un dosaggio medio di 44,6 UI/Kg per somministrazione (13), rurioctocog alfa pegol determina il minor costo medio annuo di trattamento e il minor consumo medio (€ 159.607; 221.676 UI) rispetto a turoctocog alfa pegol (€ 202.326 e 281.008 UI).
La sostanziale convenienza economica di rurioctocog alfa pegol viene confermata dall’analisi di scenario condotta nel presente lavoro che ha testato eventuali riduzioni di prezzo. Considerando una somministrazione alla settimana e tutte le possibili combinazioni di sconto, la probabilità che il costo medio annuo di trattamento di rurioctocog alfa pegol sia inferiore a quello di turoctocog alfa pegol è dell’89,5%. Il principale limite della presente analisi è costituito dall’aver paragonato dati provenienti da studi diversi, quindi, da popolazioni differenti. Sarebbe auspicabile, in futuro, poter disporre di dati osservazionali derivati dalla pratica clinica e da confronti diretti.
Conclusioni
Uno schema posologico individualizzato sulla risposta del paziente, caratterizzato, quando possibile, da una riduzione del numero di somministrazioni settimanali, rappresenterebbe un vantaggio in termini di tempo e di qualità della vita per il paziente e una strategia economicamente vantaggiosa per il SSN nel trattamento dell’emofilia A. Alla luce dei risultati qui presentati, rurioctocog alfa pegol rappresenterebbe quindi per il SSN un’opzione sostenibile, in termini di costi associati, per il trattamento di profilassi dell’emofilia A.
Acknowledgements
Gli Autori ringraziano MAPCOM Consulting e Roberto Ravasio per il contributo dato alla validazione dell’analisi e alla stesura del manoscritto.
Disclosures
Conflict of interest: FD and PA are employed by Takeda Italia S.p.A.
Financial support: This research received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors. Medical writing support was provided by Takeda Italia S.p.A
Authors contribution: All Authors contributed equally to this manuscript.
Bibliografia
- 1. Coppola A, Franchini M, Castaman G, et al; AICE ad hoc Working Group. Treatment Regimens with Bypassing Agents in Patients with Hemophilia A and Inhibitors: A Survey from the Italian Association of Hemophilia Centers (AICE). Semin Thromb Hemost. 2018;44(6):551-560. CrossRef PubMed
- 2. Roggeri DP, Zanon E, Biasoli C, Roggeri A. Extended Half-life rFVIII for the Treatment of Hemophilia A: Drugs Consumption and Patients’ Perspective. Farmeconomia. Health economics and therapeutic pathways 2020;21(1):59-68. CrossRef
- 3. Center for Disease Control and prevention. Data & Statistics on hemophilia. Online (Accessed March 2022)
- 4. Osservatorio Malattie Rare. Online (Accessed March 2022)
- 5. Giordano P, Franchini M, Lassandro G, Faienza MF, Valente R, Molinari AC. Issues in pediatric haemophilia care. Ital J Pediatr. 2013;39(1):24. CrossRef PubMed
- 6. Associazione Italiana Ematologia Oncologica Pediatrica (AIEOP). Online (Accessed March 2022)
- 7. Franchini M, Mannucci PM. Inhibitors of propagation of coagulation (factors VIII, IX and XI): a review of current therapeutic practice. Br J Clin Pharmacol. 2011;72(4):553-562. CrossRef PubMed
- 8. Björkman S, Folkesson A, Jönsson S. Pharmacokinetics and dose requirements of factor VIII over the age range 3-74 years: a population analysis based on 50 patients with long-term prophylactic treatment for haemophilia A. Eur J Clin Pharmacol. 2009;65(10):989-998. CrossRef PubMed
- 9. Jivi® (damoctocog alfa pegol) Riassunto delle caratteristiche di prodotto. Online (Accessed March 2022)
- 10. Elocta® (efmoroctocog alfa) Riassunto delle caratteristiche di prodotto. Online (Accessed March 2022)
- 11. Adynovi® (rurioctocog alfa pegol) Riassunto delle caratteristiche di prodotto. Online (Accessed March 2022)
- 12. Esperoct® (turoctocog alfa pegol) Riassunto delle caratteristiche di prodotto. Online (Accessed March 2022)
- 13. Konkle BA, Stasyshyn O, Chowdary P, et al. Pegylated, full-length, recombinant factor VIII for prophylactic and on-demand treatment of severe hemophilia A. Blood. 2015;126(9):1078-1085. CrossRef PubMed
- 14. Giangrande P, Andreeva T, Chowdary P, et al; Pathfinder™2 Investigators. Clinical evaluation of glycoPEGylated recombinant FVIII: efficacy and safety in severe haemophilia A. Thromb Haemost. 2017;117(2):252-261. CrossRef PubMed
- 15. Guidelines ATC classification and DDD assignment 2021 WHO. Online (Accessed March 2022)
- 16. Chowdary P, Mullins ES, Konkle BA, et al. Long-term safety and efficacy results from the phase 3b, open-label, multicentre Continuation study of rurioctocog alfa pegol for prophylaxis in previously treated patients with severe haemophilia A. Haemophilia. 2020;26(4):e168-e178. CrossRef PubMed
- 17. Curry N, Albayrak C, Escobar M, et al. Once-weekly prophylaxis with glycoPEGylated recombinant factor VIII (N8-GP) in severe haemophilia A: safety and efficacy results from pathfinder 2 (randomized phase III trial). Haemophilia. 2019;25(3):373-381. CrossRef PubMed
- 18. Chowdary P, Mullins E, Konkle BA, et al. Outcomes With an Extended Prophylactic Treatment Schedule of Rurioctocog Alfa Pegol in a Phase 3b, Open-label, Multicenter, CONTINUATION Study in Previously Treated Patients With Severe Hemophilia A. Presented at the 27th Congress of the International Society on Thrombosis and Haemostasis (ISTH); July 6–10, 2019; Melbourne, Australia.
- 19. AGENZIA ITALIANA DEL FARMACO DETERMINA 3 gennaio 2020 Riclassificazione del medicinale per uso umano «Adynovi», ai sensi dell’articolo 8, comma 10, della legge 24 dicembre 1993, n. 537. (Determina n. 38/2020). (20A00280) (GU Serie Generale n. 14 del 18-01-2020). Online
- 20. AGENZIA ITALIANA DEL FARMACO DETERMINA 6 luglio 2020 Riclassificazione del medicinale per uso umano «Esperoct» ai sensi dell’art. 8, comma 10, della legge 24 dicembre 1993, n. 537. (Determina n. DG 705/2020). (20A03694) (GU Serie Generale n. 178 del 16-07-2020). Online
- 21. Pierluigi Russo, Andrea Marcellusi, Matteo Zanuzzi et all. Drug Prices and Value of Oncology Drugs in Italy June 2021 Value in Health 24(28). CrossRef
- 22. Reding MT, Ng HJ, Poulsen LH, et al. Safety and efficacy of BAY 94-9027, a prolonged-half-life factor VIII. J Thromb Haemost. 2017;15(3):411-419. CrossRef PubMed
- 23. Suiter TM. First and next generation native rFVIII in the treatment of hemophilia A. What has been achieved? Can patients be switched safely? Semin Thromb Hemost. 2002;28(3):277-284. CrossRef PubMed
- 24. Wells JR, Gater A, Marshall C, Tritton T, Vashi P, Kessabi S. Exploring the Impact of Infusion Frequency in Hemophilia A: Exit Interviews with Patients Participating in BAY 94-9027 Extension Studies (PROTECT VIII). Patient. 2019;12(6):611-619. CrossRef PubMed
- 25. Kearney S, Raffini LJ, Pham TP, et al. Health-related quality-of-life and treatment satisfaction of individuals with hemophilia A treated with turoctocog alfa pegol (N8-GP): a new recombinant extended half-life FVIII. Patient Prefer Adherence. 2019;13:497-513. CrossRef PubMed