 |
AboutOpen | 2021; 8: 74-80 ISSN 2465-2628 | DOI: 10.33393/ao.2021.2260 ORIGINAL RESEARCH ARTICLE |
 |
Terapia genica e Farmacia Ospedaliera: l’esperienza dell’UOSD Farmacia Ospedaliera dell’AOU L. Vanvitelli
Gene therapy and hospital pharmacy: the experience of the Hospital Pharmacy unit of L. Vanvitelli university hospital
Background: Since hospital use of gene therapy requires close cooperation between doctors and pharmacists to ensure correct drug handling and administration, it is essential to define standard operating procedures (SOPs) for each phase of the process to ensure therapeutic success in compliance with the safety of patient and healthcare professionals. Among the available gene therapy medicines, voretigene neparvovec is used to treat hereditary dystrophy of the retina caused by biallelic mutations in the RPE65 gene. The aim of this article is to describe the experience of the Hospital Pharmacy unit of L. Vanvitelli university hospital in the management of treatment with voretigene neparvovec in the first two pediatric patients treated in Italy.
Methods: SOPs were developed for all phases of gene therapy management process (procurement, receipt, storage, handling, transport of the finished product and waste disposal). Particular attention was paid to the training of personnel involved, to ensure maximum compliance with the procedures at all stages of the process.
Results: SOPs were developed according to the European Association of Hospital Pharmacist (EAHP) policies and in full agreement with the operating procedures established by the manufacturer, ensuring correct storage and handling of the drug, as well as safe administration to patients.
Conclusions: This example confirms the importance of close collaboration in a multidisciplinary team between hospital pharmacists, ophthalmologists experienced in the treatment of patients with hereditary retinal dystrophies and surgeons experienced in subretinal surgery to ensure the correct management of gene therapy with voretigene neparvovec, through compliance with shared operating procedures.
Keywords: Gene therapy, Hospital Pharmacy, Voretigene neparvovec
Received: March 19, 2021
Accepted: July 13, 2021
Published online: August 5, 2021
AboutOpen - ISSN 2465-2628 - www.aboutscience.eu/aboutopen
© 2021 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
Il termine terapia genica si applica a qualsiasi procedura clinica a scopo terapeutico che prevede l’introduzione intenzionale di geni nelle cellule umane (1). Tale approccio consente di modificare l’espressione genica, alterando la fisiologia e il metabolismo cellulare (1).
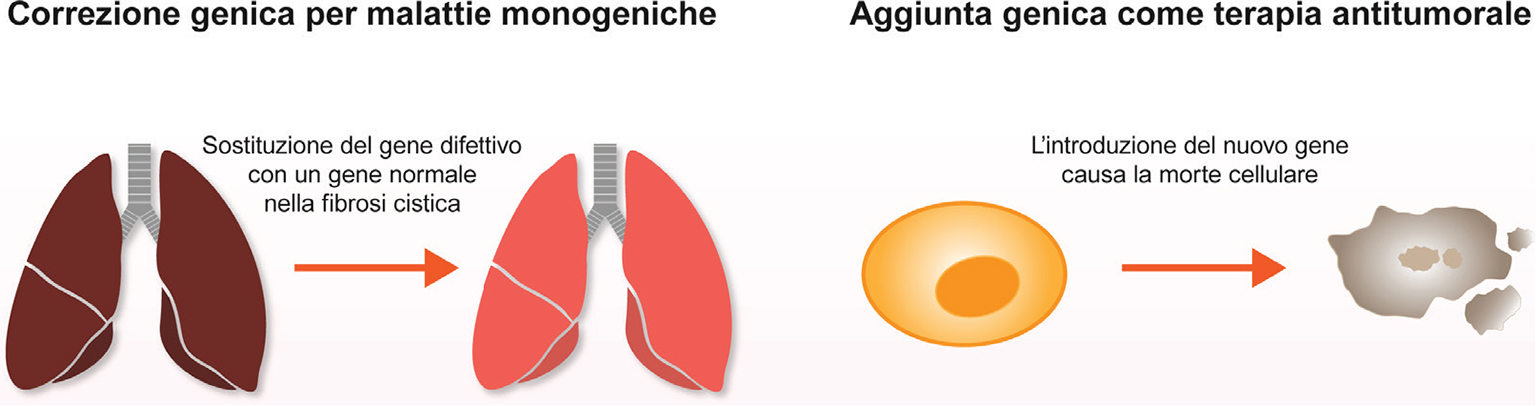
La Società Americana di Terapia Genica e Cellulare (ASGCT) definisce la terapia genica come l’introduzione o la rimozione di materiale genetico o modifiche dell’espressione genica per alterare la funzione biologica del codice genetico di un individuo, con l’obiettivo di ottenere un beneficio terapeutico (2). Questi approcci includono o la sostituzione di un gene non funzionante, responsabile della malattia, con un gene sano funzionante oppure l’introduzione di un nuovo gene nell’organismo (Fig. 1) (3). I metodi alla base della terapia genica comprendono, quindi (4,5):
• terapia genica sostitutiva, in cui un gene pienamente funzionante viene impiegato per sostituire un gene mutato;
• introduzione di un nuovo gene per aiutare a combattere una malattia;
• inibizione genica o “knockdown” mediante utilizzo di geni per inattivare un gene mutato che sta producendo in eccesso il suo prodotto utilizzando come bersaglio l’RNA di riferimento;
• gene editing, che consistente nel modificare alcune sequenze geniche specifiche in modo mirato.
Terapia genica: ambiti di utilizzo e gestione del rischio
Grazie alla terapia genica, è possibile trattare numerose malattie derivanti da mutazioni geniche in maniera mirata ed efficace, minimizzando gli effetti collaterali spesso associati ai trattamenti farmacologici sistemici (1).
La terapia genica può essere somministrata in vivo, inserendo i geni direttamente nelle cellule target nell’organismo, o ex vivo, modificando le cellule target al di fuori del corpo e reimpiantandole in seguito (1).
I geni sono, in genere, inseriti in vettori che li proteggono e li trasportano fino al nucleo delle cellule bersaglio, dove possono essere espressi per produrre la proteina terapeutica. I vettori possono essere (1):
• sintetici (non virali): il DNA viene associato a lipidi, peptidi, proteine o particelle di virus inattivati o incorporato all’interno di liposomi;
• virali: si tratta di virus privati di alcuni geni, per consentire l’inserimento di geni terapeutici. I virus più utilizzati sono:
○ retrovirus
○ adenovirus
○ herpes virus
I vettori virali sono, in genere, dotati di una maggiore efficienza rispetto ai vettori non virali, ma comportano maggiori rischi di infezione accidentale (del personale sanitario e di altri pazienti o familiari) o di contaminazione ambientale (1).
Questi vettori sono stati utilizzati per il trattamento di varie patologie, quali deficit enzimatici ereditari, tumori, HIV/AIDS, patologie infiammatorie, ulcere, patologie vascolari e neurologiche (3).
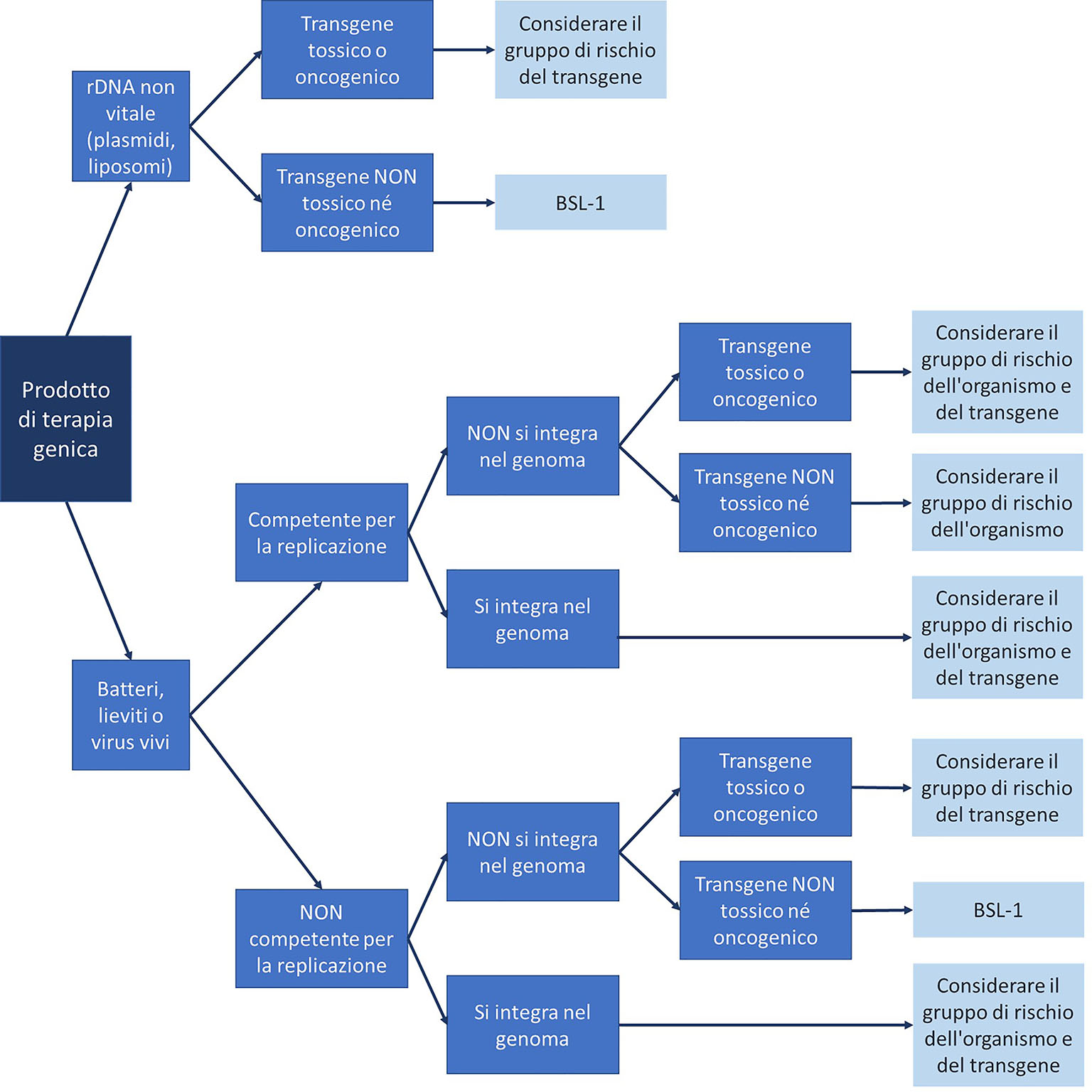
Data l’eterogeneità delle terapie geniche basate sull’utilizzo di vettori virali in termini di capacità di integrazione del gene e di potenziale pericolosità della proteina codificata, ogni terapia genica dovrebbe essere sottoposta a un’attenta valutazione del rischio (Fig. 2), che rappresenta il punto di partenza per la messa a punto di adeguate procedure per la manipolazione in sicurezza del farmaco (6).
I prodotti di terapia genica, essendo prodotti biologici, richiedono un utilizzo controllato e l’adozione di misure asettiche, al fine di salvaguardare lo stato di salute degli operatori sanitari e dei pazienti e di evitare rischi per l’ambiente. Tutti i materiali biologici potenzialmente pericolosi possono, tuttavia, essere somministrati in sicurezza in presenza di procedure standardizzate adeguate e di personale specificamente formato. Lo sviluppo di Linee Guida condivise per l’utilizzo appropriato dei prodotti di terapia genica favorirà la gestione dei singoli prodotti da parte dei singoli centri; tuttavia, in attesa che tali Linee Guida vengano rese disponibili, ogni Istituzione dovrebbe dotarsi di procedure operative standardizzate che, partendo dalle raccomandazioni delle ditta produttrice del farmaco e delle autorità regolatorie europee (EMA) e locali, prendano in considerazione tutte le possibili criticità connesse al suo utilizzo e forniscano indicazioni per la sua manipolazione e la sua somministrazione in sicurezza (6).
Il ruolo del Farmacista Ospedaliero
La terapia genica rappresenta un nuovo approccio per il trattamento di malattie genetiche rare, che definisce nuove responsabilità per il Farmacista Ospedaliero (7).
A causa della loro natura di farmaci biologicamente attivi e del frequente impiego di virus vivi come vettori, le conseguenze di errori o incidenti sono potenzialmente più gravi rispetto ai farmaci standard (3). Sebbene la gestione della terapia genica comporti problematiche specifiche e distinte rispetto agli altri medicinali, non esistono, al momento, Linee Guida specifiche da parte delle Istituzioni Scientifiche Internazionali [National Institutes of Health (NIH), FDA, Centers for Disease Control and Prevention (CDC), World Health Organization (WHO)] o delle associazioni professionali, relativamente alla manipolazione, alla preparazione e alla somministrazione dei prodotti di terapia genica (6). I NIH hanno stratificato i vettori virali utilizzati da vari prodotti di terapia genica in gruppi di rischio, ma non ci sono informazioni sufficienti sulle modalità di minimizzazione dell’esposizione e di riduzione del rischio (6).
In assenza di Linee Guida definite, le singole Istituzioni sviluppano procedure locali, che, tuttavia, risultano spesso incomplete o superate, oltre che estremamente disomogenee da un centro all’altro. Tali procedure dovrebbero prendere in considerazione il gruppo di rischio del vettore virale utilizzato per la terapia genica e il livello di sicurezza biologica richiesta, così come il rischio potenziale associato al gene “trapiantato” (Tab. I) (6).
A tal proposito, è importante ricordare che molti centri non risultano adeguati alla gestione dei prodotti di terapia genica (8):
• la maggior parte dei dipartimenti di Farmacia Ospedaliera non dispone di attrezzature asettiche per la ricostituzione dei prodotti di terapia genica o di freezer adeguati al loro stoccaggio;
• il personale non ha la formazione necessaria per la gestione di questi medicinali.
I Responsabili della Farmacia Ospedaliera possono contribuire in maniera decisiva allo sviluppo di procedure operative standardizzate che, tenendo conto livello di rischio, definiscano i requisiti minimi di sicurezza e le infrastrutture e le attrezzature necessarie per garantire la corretta manipolazione dei prodotti di terapia genica, oltre a prevedere un’adeguata formazione del personale coinvolto (6).
Con il progressivo aumento del numero di prodotti di terapia genica, il ruolo del Farmacista Ospedaliero è destinato a divenire sempre più importante per garantire la corretta gestione del farmaco e implementare un’efficace collaborazione tra farmacisti e medici (8).
| Raccomandazione | Descrizione |
|---|---|
| Comitato per la biosicurezza clinica per la gestione delle terapie geniche approvate | Comitato interdipartimentale guidato dal farmacista clinico per lo sviluppo di protocolli di manipolazione sicura e la valutazione dei prodotti di terapia genica approvati
Membri: farmacista, medico, infermiere, responsabile della biosicurezza o responsabile della sicurezza ambientale, responsabile della salute sul lavoro e personale dei servizi di smaltimento Facoltativo: farmacista specializzato in prodotti di terapia genica |
| Procedure e policy per lo sviluppo | Stoccaggio, trasporto, preparazione, distribuzione, somministrazione, decontaminazione dei rifiuti, esposizione accidentale, controllo delle infezioni, diritti dei dipendenti, prescrizione e somministrazione, disinfezione e decontaminazione di una cappa di biosicurezza di classe II, smaltimento dei rifiuti, esposizione degli operatori sanitari, sversamenti di emergenza, ricevimento e stoccaggio, preparazione, policy del dipartimento di Farmacia e formazione dei dipendenti |
| Formazione istituzionale e dei caregiver | Gli operatori sanitari coinvolti nella gestione e/o nella somministrazione della terapia genica dovrebbero essere formati sui principi di biologia molecolare della terapia genica
I caregiver dovrebbero essere formati con informazioni specifiche sul prodotto, come problemi di somministrazione, gestione dei rifiuti, escrezione virale (shedding), risposta immunitaria, sieroconversione e potenziali ulteriori test di sicurezza (p. es., test per lo stato di replicazione-competenza per vettori retrovirali) |
| Controlli ambientali | Cappa di biosicurezza di classe II, scarico verso l’esterno senza ricircolo, considerare la pressione negativa, politiche di stoccaggio delle sostanze pericolose, dispositivo calibrato di monitoraggio della temperatura durante lo stoccaggio e il trasporto, scarico canalizzato (USP 800), segnaletica dei pericoli, dispositivi di protezione individuale, contenitori a prova di fuoriuscite/perdite, spill kits ed etichette sul rischio biologico |
Ciò richiede necessariamente lo sviluppo e l’implementazione di programmi educazionali tali da permettere ai Farmacisti Ospedalieri di approfondire le giuste conoscenze per la corretta manipolazione delle terapie geniche.
Nel 2007, l’Associazione Europea dei Farmacisti Ospedalieri ha emanato delle Linee Guida dirette ai Farmacisti Ospedalieri, definendo i requisiti minimi per lo stoccaggio, il trasporto, la preparazione, la somministrazione, la decontaminazione, lo smaltimento e l’esposizione accidentale alle terapie geniche (9).
Nel 2018, la FDA ha pubblicato una bozza di Linee Guida per l’industria che definiscono le informazioni necessarie da fornire al clinico per la corretta manipolazione della terapia genica durante l’esecuzione di studi clinici. Queste procedure, tuttavia, anche se utili durante l’esecuzione dei trial clinici potrebbero non essere sufficientemente adatte alla comune pratica clinica (10).
Non esistono ancora Linee Guida che definiscano il ruolo del farmacista nella gestione della terapia genica, sia per quanto riguarda la manipolazione del medicinale, sia relativamente al suo ruolo tradizionale di coordinatore multidisciplinare (3).
In definitiva, l’avvento delle terapie geniche pone il problema che gli operatori coinvolti a tutti i livelli nella manipolazione di tali farmaci spesso non dispongono delle corrette e complete conoscenze tese alla corretta gestione degli stessi, pertanto sarebbe opportuno che i singoli centri coinvolti nella gestione della terapia genica si dotassero di opportune Linee Guida circa la manipolazione dei suddetti farmaci.
Voretigene neparvovec
Voretigene neparvovec è un medicinale utilizzato per il trattamento di adulti e bambini con perdita della vista dovuta a distrofia ereditaria della retina, una rara patologia genetica della retina causata da mutazioni bialleliche nel gene RPE65, responsabile della produzione di un enzima denominato isomerasi all-trans-retinoica, necessario per il normale funzionamento delle cellule retiniche e del ciclo visivo.
Voretigene neparvovec può essere utilizzato solo se i pazienti dispongono ancora di un numero sufficiente di cellule vitali nella retina: il farmaco, infatti, è costituito da un virus che veicola copie normali del gene RPE65 nelle cellule della retina, rendendole in grado di produrre l’enzima mancante. Tale azione contribuisce a un migliore funzionamento delle cellule della retina, rallentando la progressione della malattia. Il tipo di virus utilizzato nel medicinale (virus adeno-associato) non provoca malattie nell’uomo (11).
Voretigene neparvovec è stato valutato in uno studio condotto su 31 pazienti affetti da distrofia ereditaria della retina dovuta a mutazioni del gene RPE65. Dopo un anno di trattamento, i pazienti trattati con voretigene neparvovec hanno presentato un miglioramento della capacità visiva, che si è mantenuto invariato per almeno tre anni (11).
La ditta che commercializza voretigene neparvovec ha previsto un programma informativo e del materiale didattico destinato ai medici e ai farmacisti che utilizzano e manipolano il farmaco, al fine di garantirne l’uso corretto e di ridurre al minimo i rischi associati al medicinale e alla sua somministrazione. Inoltre, la ditta dovrà seguire per 15 anni tutti i pazienti ai quali è stato somministrato voretigene neparvovec negli studi principali, al fine di caratterizzare l’efficacia e la sicurezza a lungo termine del medicinale e di istituire un registro per raccogliere dati sulla sicurezza a lungo termine nei pazienti nell’ambito dello studio post-autorizzativo di sicurezza non interventistico (PASS) (11).
Dal momento che voretigene neparvovec è una terapia genica contenente un vettore adenovirale, la sua manipolazione richiede l’adozione delle misure di sicurezza standard per i materiali biologici potenzialmente pericolosi. È necessario tenere presente la possibile eliminazione di basse quantità di capside virale nelle lacrime e nelle secrezioni nasali fino a 7 giorni dopo la somministrazione (6).
Questo articolo condivide l’esperienza dell’UOSD di Farmacia dell’AOU L. Vanvitelli nel mettere a punto e gestire le procedure operative standardizzate per l’utilizzo di voretigene neparvovec, volte a garantire la somministrazione in sicurezza del farmaco ai primi due pazienti pediatrici affetti da distrofia ereditaria della retina trattati in Italia con questa terapia nella pratica clinica.
Metodi
Procedure operative standardizzate
Al fine di garantire la manipolazione e la somministrazione corrette di voretigene neparvovec a due pazienti pediatrici (un maschio di 9 anni e una femmina di 8 anni) affetti da distrofia ereditaria della retina, sono state messe a punto procedure operative standardizzate relative alle seguenti fasi del processo di gestione del prodotto per terapia genica:
• approvvigionamento;
• ricezione;
• stoccaggio;
• manipolazione;
• trasporto del prodotto finito;
• smaltimento dei resti di lavorazione.
Per tutte le fasi, massima attenzione è stata dedicata alla preservazione dell’integrità del prodotto, così come alla sicurezza del personale addetto, nel rispetto delle norme di Good Microbiologcal Practice e Good Manifacturing Practice, oltre che in osservanza delle norme di Sicurezza e Igiene Ambientale.
Piano di valutazione dei rischi
È stata eseguita una valutazione dei rischi per l’uomo e per l’ambiente, come previsto per l’impiego di materiale geneticamente modificato:
• identificazione di tutti i possibili effetti dannosi;
• probabilità e gravità di ogni potenziale effetto;
• misure di contenimento necessarie;
• metodi validati per lo smaltimento dei prodotti di rifiuto (inclusa l’inattivazione del materiale biologico geneticamente modificato).
Formazione del personale
Particolare attenzione è stata dedicata alla formazione del personale coinvolto, per garantire il massimo rispetto delle procedure in tutte le fasi del processo. La formazione è stata erogata da Novartis, il titolare dell’autorizzazione all’immissione in commercio, che ha concordato il contenuto e il formato del programma educazionale con l’Autorità nazionale competente.
Coordinamento delle varie unità operative
La Direttrice dell’UOSD Farmacia, in collaborazione con la Direzione Strategica, si è occupata della supervisione del progetto e del coordinamento delle varie figure coinvolte (oculisti, farmacisti, infermieri, anestesisti, case manager, ingegnere clinico, provveditore, amministrativi).
Per garantire il successo dell’intervento, sono state previste due simulazioni di tutto l’iter di preparazione, consegna agli oculisti del farmaco in sala operatoria e smaltimento dei residui.
Risultati
Procedure operative standardizzate
Approvvigionamento
La fase di approvvigionamento del farmaco ha richiesto un’importante cooperazione sia con l’Azienda Fornitrice dello stesso, sia con la componente medica del team, al fine di calendarizzare opportunamente l’arrivo del farmaco presso la Farmacia in relazione alla data prevista per l’intervento.
Pertanto, una volta che la componente medica ha comunicato la data programmata per l’intervento, la Farmacia ha proceduto all’emissione dell’ordine dello stesso all’Azienda Fornitrice.
Dal momento che l’invio della specialità medicinale avviene da un altro paese europeo, conservata e trasportata congelata a ≤−65 °C, in questa fase è stata fondamentale l’interazione con l’Azienda Produttrice, per garantire l’arrivo del farmaco presso la Farmacia Ospedaliera alcuni giorni prima dell’intervento.
Ricezione del farmaco
La fase di ricezione del farmaco ha rappresentato un momento di criticità di tutto il processo. La ricezione, infatti, ha previsto in ogni momento la presenza di un farmacista del team, al fine di garantire le condizioni di temperatura (≤−65 °C) necessarie per il mantenimento dell’integrità del principio attivo. Pertanto, il farmacista in questa fase ha supervisionato tutto il processo in accordo con i protocolli aziendali, in particolare per la verifica del mantenimento della catena del freddo dall’invio da parte dell’Azienda Produttrice alla ricezione da parte dell’Azienda Ospedaliera e al suo stoccaggio nel congelatore dedicato.
Stoccaggio
Lo stoccaggio è stato realizzato presso un congelatore dedicato in grado di garantire costantemente la temperatura ≤−65 °C; in tutto il periodo di stoccaggio, la temperatura è stata costantemente monitorata per verificare l’assenza di escursioni termiche.
Manipolazione
La manipolazione del farmaco il giorno dell’intervento è stata condotta nel pieno rispetto dei protocolli forniti al team di farmacisti dall’Azienda Fornitrice, tramite il programma educazionale di minimizzazione del rischio specifico per l’impiego della terapia genica voretigene neparvovec, circa tutte le fasi che devono essere obbligatoriamente rispettate dal momento in cui il farmaco viene prelevato dal congelatore, fino alla manipolazione vera e propria per l’allestimento dello stesso in condizioni di sterilità sotto cappa a flusso laminare.
Una volta scongelato, il medicinale non deve essere nuovamente congelato e deve essere lasciato a temperatura ambiente (inferiore a 25 °C). Dopo diluizione in condizioni asettiche, la soluzione deve essere utilizzata immediatamente; se non utilizzata immediatamente, il tempo di conservazione a temperatura ambiente (inferiore a 25 °C) non deve superare le 4 ore.
Trasporto del prodotto finito
Una volta allestito il prodotto, sempre garantendo le condizioni necessarie di sterilità e in accordo con i protocolli procedurali che sono stati forniti dall’Azienda Fornitrice, il farmaco è stato, quindi, trasportato dal personale farmacista in appositi contenitori coibentati alla sala operatoria, per l’intervento di somministrazione al paziente.
Tutte le fasi di prelevamento del farmaco, manipolazione dello stesso e trasporto all’UOC di Oculistica, sono avvenute nel totale rispetto delle procedure operative e secondo tempistiche certe, in accordo con i protocolli forniti.
Smaltimento
Al termine del processo di preparazione, si è provveduto allo smaltimento dei residui e di tutto il materiale impiegato, avendo l’accortezza di sigillare tutto ciò che è stato impiegato in appositi contenitori destinati all’incenerimento da parte di un’Azienda preposta allo smaltimento.
Piano di valutazione dei rischi
Durante le varie fasi del processo di gestione e di manipolazione del farmaco, non si è verificata alcuna criticità connessa ai rischi di impiego della terapia genica; ciò è stato reso possibile sia dal rigoroso rispetto delle procedure condivise con l’Azienda Produttrice per la manipolazione e la corretta gestione del farmaco, sia dal rigoroso rispetto delle procedure vigenti e adottate per l’inattivazione e lo smaltimento dei residui derivanti dall’utilizzo di terapie geniche.
Formazione del personale
Quattro farmacisti dell’organico strutturale hanno ricevuto una formazione specifica per l’allestimento della preparazione.
Coordinamento delle varie unità operative
Il team (oculisti/oftalmologo esperti nelle distrofie retiniche e chirurghi della retina esperti in chirurgia sottoretinica, farmacisti, infermieri, anestesisti, case manager, ingegnere clinico, provveditore, amministrativi) ha lavorato per 5 mesi per mettere a punto la strategia d’azione.
In particolare, la Farmacia ha dovuto rivedere tutta la sua organizzazione interna:
• una prima unità è stata impegnata in un lavoro sinergico con l’UOC ABS (Acquisizione Beni e Servizi), per permettere l’approvvigionamento dei dispositivi medici compatibili, necessari sia per l’allestimento, sia per la somministrazione. Dal momento che diversi di questi dispositivi non sono disponibili sul territorio italiano, è stato necessario reperirli mediante fornitori locali e nazionali anche tramite procedure d’importazione;
• un farmacista dedicato ha curato l’iter amministrativo avviato presso AIFA per l’accesso al fondo del 5% per malattie rare, che prevede il rimborso all’Azienda Ospedaliera delle spese sostenute per l’acquisizione del farmaco;
• quattro farmacisti dell’organico strutturale, suddivisi in due gruppi di lavoro, sono stati dedicati al processo di preparazione della terapia genica, dopo apposita formazione.
A seguito della collaborazione multidisciplinare realizzata tra i farmacisti e gli oculisti dell’AOU L. Vanvitelli, è stato possibile sottoporre a terapia genica con voretigene neparvovec due pazienti pediatrici affetti da distrofia retinica ereditaria. Per ciascuno dei due pazienti trattati sono stati eseguiti 2 interventi chirurgici a distanza di quindici giorni l’uno dall’altro: tale intervallo temporale è legato ai tempi di recupero necessari tra la prima operazione a un occhio e la seconda all’altro occhio.
Discussione
Malgrado la preesistente consapevolezza del ruolo fondamentale del Farmacista Ospedaliero nel garantire la preparazione del farmaco in sicurezza e secondo le Norme di Buona Preparazione della Farmacopea Ufficiale, nel caso di voretigene neparvovec ci si è trovati di fronte a un vero e proprio cambio di paradigma, in quanto terapie geniche veicolate da virus non erano mai state preparate prima in Italia. La manipolazione del farmaco, a partire dallo stoccaggio e fino allo smaltimento dello stesso, ha richiesto la riorganizzazione del lavoro di routine del Servizio di Farmacia Ospedaliera in generale e dell’Unità di manipolazione di chemioterapici antiblastici (UMACA) in particolare.
Sono state, a tale scopo, messe a punto procedure operative standardizzate, in conformità con le procedure dell’European Association of Hospital Pharmacist (EAHP), al fine di garantire il rispetto dei requisiti di qualità e sicurezza per ogni fase del processo. Tutto il processo di gestione del farmaco è stato, inoltre, condotto in pieno accordo con le procedure operative stabilite dall’Azienda Produttrice e dal programma educazionale di minimizzazione del rischio di voretigene neparvovec, per garantire la corretta conservazione nonché la corretta manipolazione del farmaco. Lo sviluppo di queste procedure operative ha necessariamente coinvolto tutti gli attori di tale processo (farmacisti, medici, anestesisti), che hanno dovuto dar vita a un sistema di cooperazione a 360 gradi. La riuscita di questo progetto di terapia genica condotto presso l’AOU Ospedaliera Universitaria L. Vanvitelli è stata possibile solo grazie al notevole impegno di tutte le persone coinvolte: in particolare in un arco temporale di circa 5 mesi, il Servizio di Farmacia Ospedaliera ha dovuto, soprattutto nelle fasi iniziali, rivedere completamente le priorità, in termini sia di gestione delle risorse umane, sia di suddivisione delle ore lavorative. Solo il reclutamento di un numero sufficiente di operatori dedicati al progetto per un periodo di tempo adeguato ha consentito l’acquisizione in tempi utili di tutti i dispositivi necessari per l’allestimento e la somministrazione del farmaco, nonché la necessaria formazione (4 ore) del personale farmacista, anche mediante simulazioni (durata 3 ore). I farmacisti coinvolti nella gestione della terapia genica con voretigene neparvovec si sono trovati, infatti, ad affrontare una realtà ancora inesplorata: sebbene, infatti, il farmacista sia tradizionalmente esperto di galenica (soprattutto oncologica), l’allestimento di una terapia genica in ambito oculistico non era mai stato realizzato in Italia. La conseguente riorganizzazione delle attività del Servizio di Farmacia ha comportato diverse criticità nello svolgimento quotidiano delle attività, che, tuttavia, sono state superate grazie agli sforzi di cooperazione con il team medico coinvolto, consentendo di realizzare, presso l’Azienda Vanvitelli, qualcosa di mai tentato fino a oggi in Italia.
In conclusione, alla luce del ruolo sempre più importante che la terapia genica svolge nel trattamento di patologie rare, la figura del farmacista assume una particolare rilevanza nel garantire il rispetto dei requisiti di qualità e sicurezza necessari per assicurare l’efficacia del trattamento e limitare i rischi sia per il paziente, sia per il personale sanitario. Dal momento che le Linee Guida internazionali messe a punto per la corretta gestione della terapia genica nell’ambito dei trial clinici non sempre risultano applicabili alla pratica clinica reale, è importante che le singole Istituzioni impegnate nella somministrazione di terapie geniche mettano a punto procedure operative standardizzate locali, che garantiscano l’ottimale gestione della terapia da parte di tutti gli attori coinvolti, dai farmacisti ai medici oculisti.
Acknowledgements
We thank the Direzione Strategica of the AOU L. Vanvitelli for their support and special thanks to Prof. Simonelli of the UOC Oculistica. The authors thank Elena Sarugeri for medical writing assistance on behalf of Health Publishing & Services Srl. This unconditional support was funded by Novartis Farma SpA.
Disclosures
Conflict of interest: The authors declare no conflict of interest.
Financial support: This research received no specific grant from any funding agency in the public, commercial, or not-for-profit sectors.
Bibliografia
- 1. Stoner NS, Gibson RN, Edwards J. Development of procedures to address health and safety issues in the administration of gene therapy within the clinical setting. J Oncol Pharm Pract. 2003;9(1):29-35. CrossRef
- 2. American Society of Gene and Cell therapy. Gene and cell therapy FAQ’s. 2018; Online (Accessed November 2020).
- 3. Roth RI, Fleischer NM. Gene therapy: applications to pharmacy practice. J Am Pharm Assoc (Wash). 2002;42(5):694-698. CrossRef PubMed
- 4. Dunbar CE, High KA, Joung JK, Kohn DB, Ozawa K, Sadelain M. Gene therapy comes of age. Science. 2018;359(6372):eaan 4672. CrossRef PubMed
- 5. Stoner N. Gene therapy applications. Clin Pharm. 2009;1:270-273.
- 6. Petrich J, Marchese D, Jenkins C, Storey M, Blind J. Gene Replacement Therapy: A Primer for the Health-system Pharmacist. J Pharm Pract. 2020;33(6):846-855. CrossRef PubMed
- 7. Smith TJ. Gene Therapy: opportunities for pharmacy in the 21st century. Am J Pharma educ. 1996;60(2):213-215.
- 8. Stoner N. Are UK hospital pharmacy departments ready for the rise of gene therapy medicinal products? Expert Opin Biol Ther. 2018;18(8):837-840. CrossRef PubMed
- 9. Vulto A, Stoner N, Pharm DC, et al. European Association of Hospital Pharmacists (EAHP). Guidance on the Pharmacy Handling of Gene Medicines. EJHP Pract. 2007;13(5):29-39. Online
- 10. US Food and Drug Administration. Draft Guidance for Industry: Chemistry, Manufacturing, and Control (CMC) Information for Human Gene Therapy Investigational New Drug Applications (INDs). 2020. (Accessed February 2021). Online
- 11. European Medicines Agency (EMA). Voretigene neparvovec. 2018; Online (Accessed November 2020)