 |
AboutOpen | 2020; 7(1): 103-111 ISSN 2465-2628 | DOI: 10.33393/abtpn.2020.2190 ORIGINAL RESEARCH ARTICLE |
 |
Analisi di costo-efficacia dei farmaci ad azione antivirale diretta nel trattamento dell’epatite cronica C nella popolazione carceraria italiana
Cost-effectiveness analysis with direct-acting antivirals in a cohort of HCV-infected inmates in Italy
Background: The high prevalence rate of HCV infection in prison suggests the need of tailored interventions on people who are incarcerated. Given their high-risk behavior, inmates represent a reservoir of HCV infection for the community.
Objective: To evaluate the cost-effectiveness of a strategy based on direct-acting antivirals (DAAs) versus no drug strategy in HCV-infected inmates, from the perspective of the Italian National Health System (iNHS).
Methods: A previous Markov model was adapted to the Italian setting to evaluate the direct medical costs and health outcomes (quality-adjusted life years, QALY) throughout the life of HCV-infected inmates. Epidemiological data, patient characteristics (genotype, METAVIR classification), DAAs sustained virological response (SVR), annual likelihood of transition, treatment costs and utilities were gathered from the literature. The DAAs strategy included the administration of elbasvir/grazoprevir or sofosbuvir/velpatasvir or glecaprevir/pibrentasvir. Direct medical costs and QALYs were discounted at a 3.0% annual rate. Cost-effectiveness was evaluated as incremental cost-effectiveness ratio (€, 2019) per QALY gained. A deterministic sensitivity analysis (DSA) was performed.
Results: Over a lifetime horizon, the DAAs strategy showed higher health costs per patient compared to no drugs strategy in the base-case analysis (€ 42,571 vs. € 26,119). However, it was associated with an increase of QALYs gained (21.14 vs. 15.67), showing an incremental cost-effectiveness ratio of € 3,010 per QALY. The sensitivity analysis confirmed the base-case results.
Conclusions: Extending the DAAs treatment to HCV-infected inmates was estimated to be cost effective from the perspective of the Italian NHS, regardless genotype and METAVIR classification.
Keywords: Cost, Direct-acting antivirals, HCV, HCV-infected inmates, Italian NHS
Received: October 16, 2020
Accepted: November 19, 2020
Published online: December 23, 2020
© 2020 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Any commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione e obiettivi
L’infezione causata dal virus dell’epatite C (HCV) è caratterizzata dalla difficoltà del sistema immunitario di eliminare il virus nella fase acuta, fase che determina il successivo sviluppo dell’epatite cronica C (CHC) in più del 70% dei pazienti (1). Il danno epatico cronico può determinare lo sviluppo della cirrosi fino nel 25% dei pazienti con CHC (2). Nella maggior parte dei soggetti, la progressione della malattia è lenta e asintomatica, ma, una volta che la cirrosi si è sviluppata, la probabilità annua che si trasformi in cirrosi scompensata o in carcinoma epatico è, rispettivamente, del 4% e dell’1,5% (3).
Il target clinico nel trattamento dell’HCV è costituito dal raggiungimento della risposta virologica sostenuta (SVR), in grado di prevenire la progressione della malattia, di ridurre la mortalità per malattie del fegato e di aumentare la qualità di vita dei pazienti (4,5).
La terapia dell’HCV è radicalmente cambiata, negli ultimi anni, grazie alla disponibilità dei farmaci ad azione antivirale diretta (DAAs) che hanno permesso di raggiungere una SVR superiore al 95%. Dal momento che, nella maggior parte dei casi, sono regimi liberi da interferone e vengono somministrati oralmente per un breve periodo di tempo (rispetto a quanto avveniva con i precedenti trattamenti), i DAAs consentono al paziente di raggiungere un’elevata aderenza alla terapia e di ridurre al minimo gli eventi avversi (6, 7, 8).
Secondo i dati stimati da un modello di simulazione Bayesiano, rispetto all’attuale popolazione italiana, sono circa 467.000 i soggetti con HCV, di cui 330.000 (stadio F0-F3) asintomatici e potenzialmente non diagnosticati (9). Considerando una stratificazione per gruppi ad alto rischio di infezione, il modello ha stimato che circa il 52% e circa il 28% dei soggetti asintomatici sia costituito, rispettivamente, da consumatori di droghe iniettive e da persone tatuate. Se così fosse, la presenza di un elevato numero di pazienti asintomatici evidenzierebbe l’inadeguatezza delle attuali strategie di screening adottate per l’HCV, che, di fatto, non includerebbero tali soggetti asintomatici.
Questo unmet need, vale a dire l’inadeguatezza delle attuali strategie di screening, trova riscontro anche nelle conclusioni di una recente indagine epidemiologica condotta in Campania, Lazio e Piemonte (10), dove si afferma che, tra i soggetti che necessitano di un trattamento anti HCV, debbano essere contemplati anche i detenuti, individui che, secondo la definizione adottata dal Direttore Generale dell’Organizzazione Mondiale della Sanità (2016/2017), rientrano nella categoria delle “persone bisognose” (10,11). A tal proposito, i principi di base delle Nazioni Unite per il trattamento dei detenuti stabiliscono che a questi ultimi “deve essere garantito l’accesso ai servizi sanitari disponibili senza discriminazioni sulla base della loro situazione legale” (12). Inoltre, la Dichiarazione di Dublino su HIV e AIDS afferma che “una buona salute in carcere corrisponde a una buona salute pubblica” (13). Sfortunatamente, questo principio non sempre viene applicato. Infatti, in molti Paesi europei, i detenuti, rispetto ai cittadini liberi, hanno un accesso limitato all’assistenza sanitaria (14). In realtà, questa limitazione è in contrasto con il fatto che la popolazione carceraria sembra essere caratterizzata da una maggiore prevalenza di infezione da HCV rispetto alla popolazione generale (popolazione generale 2,5-3,5%; popolazione carceraria: 22,8-38,0%) (11). All’interno di questo scenario, la Società Italiana di Medicina e Sanità Penitenziaria (SIMSPe-ONLUS) ha promosso, tramite la costituzione di un panel di esperti, la stesura di raccomandazioni pratiche per la gestione dell’infezione da HCV in ambito penitenziario, soprattutto a fronte della disponibilità dei DAAs (11).
Obiettivo
Lo scopo della presente analisi economica consiste nel valutare, nella popolazione carceraria HCV RNA positiva, il rapporto incrementale di costo-efficacia della strategia che ne prevede il trattamento con farmaci ad azione antivirale diretta (DAAs), rispetto a una strategia alternativa che, invece, non prevede alcun trattamento.
Materiali e metodi
Tipologia di analisi
Con la finalità di confrontare l’efficacia e i costi associati alle due alternative considerate (trattamento con DAAs o nessun trattamento) è stata condotta un’analisi di costo-efficacia (Cost Effectiveness Analysis, CEA) incrementale, assumendo, come prospettiva di riferimento, quella del Servizio Sanitario Nazionale (SSN) (15). Come misura di outcome sono stati considerati gli anni di vita corretti per la qualità (Quality Adjusted Life Years, QALY), mentre, come tipologia di costi, sono stati valutati quelli diretti sanitari, la cui stima è riferita al 2019. Sia i costi che gli outcome che si manifestano oltre l’anno sono stati scontati applicando un tasso annuo del 3,0% (16). Rapportando i dati di outcome (QALY) ai dati di costo (costi diretti sanitari) associati alle due strategie di trattamento, è stato calcolato il rapporto di costo-efficacia incrementale (ICER) per anno di vita corretto per la qualità (QALY) guadagnato.
Popolazione
L’analisi di costo-efficacia è stata condotta in riferimento a una coorte di 3659 detenuti HCV RNA positivi. La stima del numero dei carcerati potenzialmente trattabili con DAAs è riportata in dettaglio nella Tabella I. In data 30 ottobre 2019, il numero complessivo di detenuti indicato dal Ministero della Giustizia è pari a 60.985; (17). Sulla base dei dati prodotti da recenti pubblicazioni, si stima che il 10% della popolazione carceraria sia portatore di infezione da HCV (18) e che il 60% di questa popolazione sia HCV RNA positiva (19,20). La Tabella I fornisce, inoltre, la stratificazione della coorte per genotipo (21) e grado di fibrosi (22).
Modello di Markov
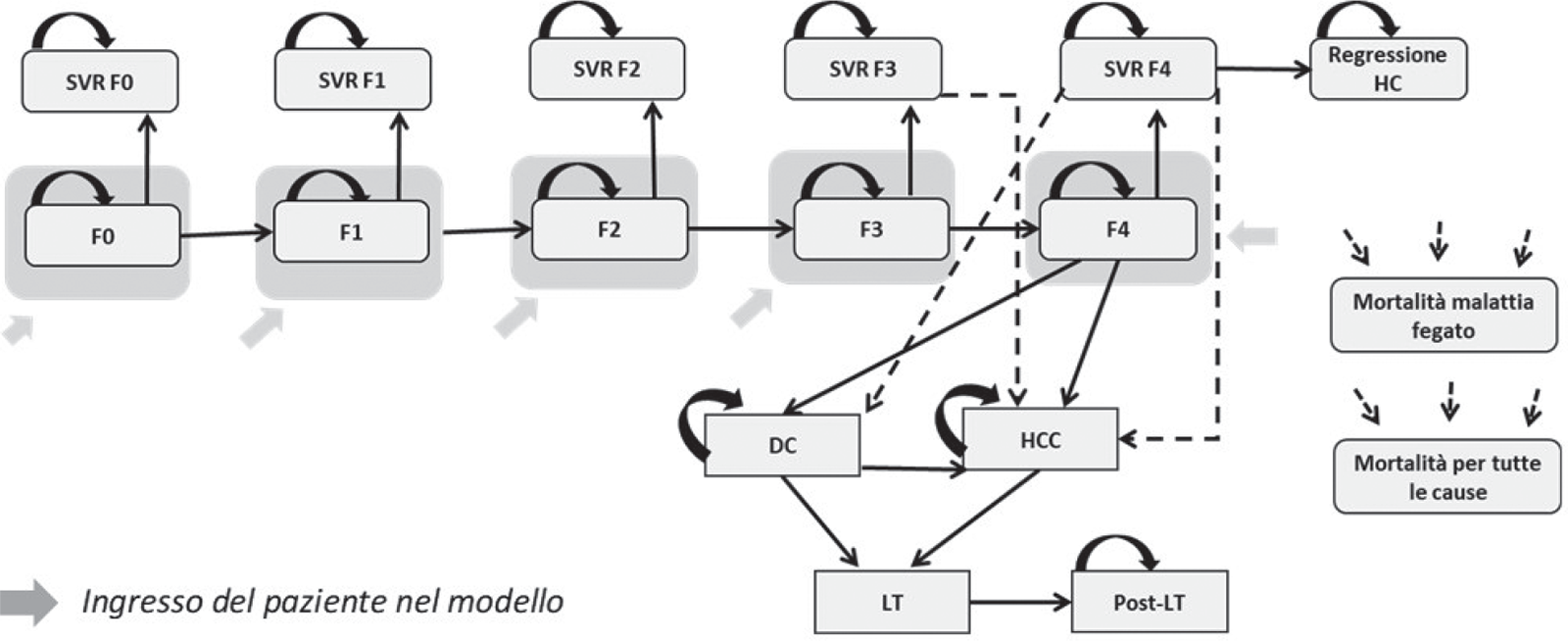
L’analisi di costo-efficacia è stata condotta utilizzando un pre-esistente modello di Markov, che ha descritto la progressione della malattia lungo un orizzonte temporale lifetime per le due strategie considerate (23). Il modello di simulazione è costituito da 17 stati di salute attraverso i quali il paziente può muoversi in funzione della propria storia di malattia. La simulazione avviene sulla base di cicli annuali. Le probabilità di transizione, associate a ognuno degli stati di salute, sono riferite a dati di letteratura, il cui dettaglio è riportato nella Tabella II (24,25,26,27,28,29,30,31). I pazienti possono entrare nel modello in funzione di differenti stati di fibrosi (da F0 a F4) (Fig. 1). A differenza di coloro che non ricevono il trattamento, i soggetti trattati con DAAs si possono muovere anche negli stati di SVR in accordo con i tassi di risposta virologica sostenuta. I pazienti negli stati di salute SVR F0-F2 vengono considerati guariti e rimangono in questa condizione fino al decesso per tutte le cause. I pazienti che raggiungono lo stato di salute SVR F3, sebbene abbiano ottenuto un miglioramento della malattia, sono, comunque, caratterizzati da un rischio di sviluppare il carcinoma epatocellulare (HCC). Nello stato di salute SVR F4, il paziente può sperimentare una stabilizzazione della malattia o una regressione della cirrosi epatica o, al contrario, può sviluppare complicazioni correlate alla cirrosi, come cirrosi scompensata (DC) o carcinoma epatocellulare (HCC). I pazienti che non ottengono una SVR (trattati non responder) possono rimanere nel corrente stato di fibrosi o muoversi verso gli altri stati di salute previsti dal modello, come accade per i pazienti che non ricevono alcun trattamento. Nel caso di cirrosi scompensata o di carcinoma epatocellulare, il modello prevede la possibilità del trapianto di fegato (LT). Nel caso di trapianto, il paziente rimane in tale stato di salute per un solo anno, per poi passare allo stato di salute post trapianto, nel quale rimane fino alla fine del periodo di osservazione. Il tasso di mortalità associato ai pazienti in SVR o in regressione da cirrosi epatica, indipendentemente dal grado di fibrosi, è uguale a quello di mortalità per tutte le cause stratificate per classe di età. Ai pazienti con uno stadio di malattia più avanzato (cirrosi scompensata, carcinoma epatocellulare, trapianto e post trapianto) è stato associato il tasso di mortalità per malattie del fegato (Tab. II).
| Parametri | Dato | Fonte | |
|---|---|---|---|
| A | Numero detenuti (30/10/2019) | 60.985 | (17) |
| B | % detenuti portatori di infezioni da HCV | 10% | (18) |
| C | Numero detenuti con epatiti croniche (F0-F4) | 6.099 | Calcolato (A*B) |
| D | % detenuti con epatiti croniche HCV RNA positivi | 60% | (19,20) |
| E | Numero detenuti con epatiti croniche HCV RNA positivi | 3.659 | Calcolato (C*D) |
| F | Numero detenuti con epatiti croniche (F0-F2) | 2.378 | Calcolato da (21) |
| G | Numero detenuti con epatiti croniche (F3-F4) | 1.281 | Calcolato da (21) |
| H | Numero detenuti con epatiti croniche G1 | 1.855 | Calcolato da (22) |
| I | Numero detenuti con epatiti croniche G2 | 223 | Calcolato da (22) |
| L | Numero detenuti con epatiti croniche G3 | 1.314 | Calcolato da (22) |
| M | Numero detenuti con epatiti croniche G4 | 267 | Calcolato da (22) |
| Stati di salute del modello | Dato | Fonte | |
|---|---|---|---|
| Da | A | ||
| F0 | F1 | 0,131 | (24) |
| F1 | F2 | 0,080 | (24) |
| F2 | F3 | 0,133 | (24) |
| F3 | F4 | 0,134 | (24) |
| HCC | 0,011 | (25) | |
| SVR F3 | HCC | 0,003 | (25) |
| F4 | DC | 0,040 | (26) |
| HCC | 0,015 | (27) | |
| SVR F4 | DC | 0,003 | (25) |
| HCC | 0,006 | (25) | |
| Regressione dell’HC | 0,055 | (28) | |
| Cirrosi scompensata | HCC | 0,068 | (29) |
| LT | 0,023 | (30) | |
| Mortalità malattie fegato | 0,138 | (29) | |
| Carcinoma epatocellulare | LT | 0,040 | (29) |
| Mortalità malattie fegato | 0,430 | (27,31) | |
| Trapianto del fegato | Post LT | 1,000 | Assunzione |
| Mortalità malattie fegato | 0,210 | (27) | |
| Post trapianto fegato | Mortalità malattie fegato | 0,057 | (27) |
SVR = risposta virologica sostenuta; HCC = carcinoma epatocellulare; CD = cirrosi scompensata; HC = cirrosi epatica; LT = trapianto del fegato.
Efficacia del trattamento
Tra le terapie attualmente disponibili in Italia per il trattamento dell’HCV nel presente modello, sono stati valutati i seguenti regimi DAAs, poiché maggiormente utilizzati: elbasvir/grazoprevir, sofosbuvir/velpatasvir e glecaprevir/pibrentasvir.
Invece di inserire nel modello una serie di specifiche strategie di trattamento suddivise per ognuno dei tre regimi DAAs, è stato assunto che ad ogni singolo paziente sia somministrato il miglior regime in funzione del genotipo, del grado di fibrosi, dello stadio della malattia e della storia clinica, determinando, così, i migliori risultati di efficacia (SVR). Sulla base di questa assunzione per i tre DAAs è stato considerato un tasso di SVR del 98%, estrapolato da una recente pubblicazione che ha riportato per questi farmaci valori equivalentemente elevati di SVR nei pazienti cirrotici e pre-cirrotici compensati, indipendentemente da genotipo, grado di fibrosi, esperienza di trattamento o età (32).
Costi di trattamento
Il costo medio per paziente trattato con DAAs pari a € 37.000 è stato calcolato come media semplice dei costi per il trattamento di ciascuno dei tre regimi antiretrovirali considerati. Nello specifico, tale costo è stato costruito facendo riferimento al relativo prezzo ex-factory al netto delle riduzioni obbligatorie di legge e del relativo schema di somministrazione (33,34,35). Il costo medio per il monitoraggio riguardante la somministrazione dei DAAs, calcolato sulla base del parere di un panel di esperti, è di € 545,92. La Tabella III mostra il dettaglio delle singole voci di costo considerate (36).
| Costo medio monitoraggio DAAs | € 545,92 | ||
|---|---|---|---|
| Esami pretrattamento | € 307,88 | ||
| Anticorpi anti HCV | 91.19.5 | VIRUS EPATITE C [HCV] ANTICORPI | € 10,01 |
| Anticorpi anti HIV | 91.22.4 | VIRUS IMMUNODEF. ACQUISITA [HIV 1-2] ANTICORPI | € 10,90 |
| Anticorpi anti HbSAg | 91.18.3 | VIRUS EPATITE B [HBV] ANTICORPI HBsAg | € 10,01 |
| HCV RNA | 91.19.3 | VIRUS EPATITE C [HCV] ANALISI QUALITATIVA DI HCV RNA | € 63,01 |
| HCV genotipo | 91.20.2 | VIRUS EPATITE C [HCV] TIPIZZAZIONE GENOMICA | € 77,47 |
| Emocromo completo | 90.62.2 | EMOCROMO: Hb, GR, GB, HCT, PLT, IND. DERIV., F. L. | € 3,17 |
| Transaminasi | 90.09.2 | ASPARTATO AMINOTRANSFERASI (AST) (GOT) [S] | € 1,04 |
| 90.04.5 | ALANINA AMINOTRANSFERASI (ALT) (GPT) [S/U] | € 1,00 | |
| Bilirubina totale | 90.10.4 | BILIRUBINA TOTALE | € 1,13 |
| Gamma GT | 90.25.5 | GAMMA GLUTAMIL TRANSPEPTIDASI (gamma GT) [S/U] | € 1,13 |
| Fosfatasi alcalina | 90.23.5 | FOSFATASI ALCALINA | € 1,04 |
| Creatinina | 90.16.3 | CREATININA [S/U/dU/La] | € 1,13 |
| Glicemia | 90.26.4 | GLUCOSIO (curva da carico 3 determinazioni) | € 2,38 |
| Ecografia addome | 88.76.1 | ECOGRAFIA ADDOME COMPLETO | € 60,43 |
| Fibroscan | 88.74.2 | ECO(COLOR)DOPPLER DEL FEGATO E DELLE VIE BILIARI | € 43,38 |
| Visita medica | 89.7 | VISITA GENERALE | € 20,66 |
| Visita medica | 89.7 | VISITA GENERALE | € 20,66 |
| Esami durante trattamento | € 55,78 | ||
| Visita medica | 89.7 | VISITA GENERALE | € 20,66 |
| Numero medio visite* | 2,70 | ||
| Esami follow-up termine trattamento | € 91,13 | ||
| HCV RNA | 91.19.3 | VIRUS EPATITE C [HCV] ANALISI QUALITATIVA DI HCV RNA | € 63,01 |
| Emocromo completo | 90.62.2 | EMOCROMO: Hb, GR, GB, HCT, PLT, IND. DERIV., F. L. | € 3,17 |
| Transaminasi | 90.09.2 | ASPARTATO AMINOTRANSFERASI (AST) (GOT) [S] | € 1,04 |
| 90.04.5 | ALANINA AMINOTRANSFERASI (ALT) (GPT) [S/U] | € 1,00 | |
| Bilirubina totale | 90.10.4 | BILIRUBINA TOTALE | € 1,13 |
| Creatinina | 90.16.3 | CREATININA [S/U/dU/La] | € 1,13 |
| Visita medica | 89.7 | VISITA GENERALE | € 20,66 |
| Esami follow-up 3 mesi termine trattamento | € 91,13 | ||
| HCV RNA | 91.19.3 | VIRUS EPATITE C [HCV] ANALISI QUALITATIVA DI HCV RNA | € 63,01 |
| Emocromo completo | 90.62.2 | EMOCROMO: Hb, GR, GB, HCT, PLT, IND. DERIV., F. L. | € 3,17 |
| Transaminasi | 90.09.2 | ASPARTATO AMINOTRANSFERASI (AST) (GOT) [S] | € 1,04 |
| 90.04.5 | ALANINA AMINOTRANSFERASI (ALT) (GPT) [S/U] | € 1,00 | |
| Bilirubina totale | 90.10.4 | BILIRUBINA TOTALE | € 1,13 |
| Creatinina | 90.16.3 | CREATININA [S/U/dU/La] | € 1,13 |
| Visita medica | 89.7 | VISITA GENERALE | € 20,66 |
*Sono state considerate 3 visite per elbasvir/grazoprevir e sofosbuvir/velpatasvir e 2 visite per glecaprevir/pibrentasvir.
| Stato di salute del modello | Costo | Fonte |
|---|---|---|
| F0 | € 175,95 | (37) |
| F1 | € 175,95 | (37) |
| F2 | € 175,95 | (37) |
| F3 | € 941,54 | (37) |
| F4 | € 1354,00 | (37) |
| SVR F0 | € 0,00 | (37) |
| SVR F0 (secondo anno e successivi) | € 0,00 | (37) |
| SVR F1 | € 0,00 | (37) |
| F1 SVR (secondo anno e successivi) | € 0,00 | (37) |
| F2 SVR | € 0,00 | (37) |
| F2 SVR (secondo anno e successivi) | € 0,00 | (37) |
| F3 SVR | € 175,95 | (37) |
| F3 SVR (secondo anno e successivi) | € 175,95 | (37) |
| F4 SVR | € 1354,00 | (37) |
| F4 SVR (secondo anno e successivi) | € 1354,00 | (37) |
| Regressione della cirrosi | € 175,95 | Assunzione |
| Regressione della cirrosi
(secondo anno e successivi) |
€ 0,00 | Assunzione |
| Cirrosi scompensata | € 4333,89 | (38) |
| Carcinoma epatocellulare | € 14.598,48 | (38) |
| Trapianto fegato | € 63.335,14 | (38) |
| Post trapianto fegato | € 4729,00 | (38) |
| Post trapianto fegato (anni successivi) | € 4729,00 | (38) |
I costi sanitari associati a ciascuno stato di salute previsto dal modello di Markov sono stati estrapolati da differenti studi sull’HCV condotti in ambito nazionale (Tab. IV) (37,38).
Utilità
L’utilità misura il valore della qualità della vita percepita dal paziente nei differenti stati di salute previsti dal modello. Le utilità, o valori di utilità, associate ad ogni stato di salute sono state estrapolate dalla letteratura e riportate in dettaglio nella Tabella V (24).
Analisi di sensibilità
Per valutare la solidità del modello in risposta a scostamenti che, nella realtà, potrebbero verificarsi rispetto ai valori di base dei parametri utilizzati, è stata condotta un’analisi deterministica (deterministic sensitivity analysis, DSA). Nello specifico, sono stati fatti variare separatamente (One Way Sensitivity Analysis, OWSA) i seguenti parametri, in base al relativo range di variazione (massimo e minimo) o, in mancanza di tale dato, assumendo una variazione del ±20% rispetto al valore del caso base:
| Stato di salute del modello | Utilità | Fonte | ||
|---|---|---|---|---|
| Valore | Min | Max | ||
| F0 | 0,980 | 0,920 | 1,000 | (24) |
| F1 | 0,980 | 0,920 | 1,000 | (24) |
| F2 | 0,920 | 0,720 | 1,000 | (24) |
| F3 | 0,790 | 0,770 | 0,810 | (24) |
| F4 | 0,760 | 0,700 | 0,790 | (24) |
| SVR F0 | 1,000 | 0,980 | 1,000 | (24) |
| SVR F1 | 1,000 | 0,980 | 1,000 | (24) |
| SVR F2 | 0,933 | 0,920 | 1,000 | (24) |
| SVR F3 | 0,860 | 0,820 | 0,900 | (24) |
| SVR F4 | 0,830 | 0,790 | 0,870 | (24) |
| Regressione della cirrosi | 0,860 | 0,820 | 0,900 | (24) |
| Cirrosi scompensata | 0,690 | 0,440 | 0,690 | (24) |
| Carcinoma epatocellulare | 0,670 | 0,600 | 0,720 | (24) |
| Trapianto fegato | 0,500 | 0,400 | 0,690 | (24) |
| Post trapianto fegato | 0,770 | 0,570 | 0,770 | (24) |
–risposta virologica sostenuta (–20%)
–valori di utilità (range: minimo-massimo)
–probabilità di transizione (±20%)
–altri costi di trattamento (±20%)
Dal momento che quello considerato nel caso base non riflette l’attuale prezzo di cessione dei regimi DAAs a carico delle strutture ospedaliere, in quanto vengono praticati degli sconti nascosti finalizzati a ridurre l’impatto economico del trattamento farmacologico a carico del SSN, è stata condotta un’analisi di scenario finalizzata a stimare l’impatto sul risultato del caso base di quattro scaglioni progressivi di sconto applicati al costo medio dei DAAs del 20%, del 40%, del 60% e dell’80%.
Risultati
Costo-efficacia incrementale
Considerando un orizzonte lifetime, la sopravvivenza media corretta per la qualità associata alla somministrazione di uno dei tre regimi DAAs determina un incremento di 5,47 QALY rispetto al non somministrare alcun trattamento nella popolazione carceraria HCV RNA positiva (Tab. VI). La somministrazione dei DAAs in questo setting di pazienti determinerebbe un incremento dei costi associati al trattamento farmacologico (€ 36.461,17) e al relativo monitoraggio (€ 537,97), costi che, in parte, verrebbero compensati da una significativa riduzione dei costi di gestione dell’HCV (–€ 20.546,96), dovuta alla progressione della malattia epatica. Rapportando i costi incrementali ai QALY incrementali, si otterrebbe un costo incrementale per anno di vita guadagnato di € 3.010,07 (Tab. VI).
| Trattamento DAAs | Nessun trattamento | Differenza | |
|---|---|---|---|
| Outcome | |||
| Quality Adjusted Life Years | 21,14 | 15,67 | 5,47 |
| Costo di trattamento | |||
| Costo totale | € 42.570,96 | € 26.118,78 | € 16.452,18 |
| DAAs | € 36.461,17 | € 0,00 | € 36.461,17 |
| Monitoraggio DAAs | € 537,97 | € 0,00 | € 537,97 |
| Gestione della malattia | € 5571,82 | € 26.118,78 | – € 20.546,96 |
| ICER x QALY | € 3010,07 |
In Italia, non esistono soglie definite di accettabilità a cui poter rapportare l’ICER qui stimato. Tuttavia, le Linee Guida AIES (Associazione Italiana di Economia Sanitaria) riportano come plausibile soglia di accettabilità un valore di € 40.000 per QALY guadagnato (39). Se si confronta, quindi, tale soglia con l’ICER per QALY qui stimato, si può ritenere che la somministrazione dei DAAs nella popolazione carceraria RNA positiva sia un’opzione terapeutica costo-efficace.
Analisi di sensibilità
Nella Tabella VII sono riportati i risultati dell’analisi di sensibilità. Nello specifico, la DSA condotta conferma la validità dei risultati del caso base. In tutti i confronti (SVR, Utilità, probabilità di transizione e costi di trattamento), la variabilità dell’ICER per QALY rispetto al caso base è risultata minima (€ 2.258,22–€ 4.536,11).
| Parametri | Variazione | ICER | |
|---|---|---|---|
| QALY | Costo | ||
| Caso base | 5,47 | € 16.452,18 | € 3.010,07 |
| Analisi di sensibilità | |||
| SVR | |||
| –20% | 4,48 | € 20.320,80 | € 4.536,11 |
| Utilità | |||
| max | 5,65 | € 16.452,18 | € 2.910,06 |
| min | 6,44 | € 16.452,18 | € 2.553,62 |
| Probabilità transizioni | |||
| +20% | 6,41 | € 16.137,61 | € 2.518,92 |
| –20% | 4,50 | € 17.487,94 | € 3.887,89 |
| Altri costi di trattamento | |||
| +20% | 5,47 | € 12.342,79 | € 2.258,22 |
| –20% | 5,47 | € 20.561,57 | € 3.761,92 |
La Figura 2 riporta, invece, i risultati dell’analisi di scenario. Con uno sconto del costo medio annuo di trattamento dei DAAs considerato, nel caso base, superiore al 45%, l’opzione che prevede la somministrazione dei DAAs nella popolazione carceraria HCV RNA positiva diviene dominante, ovvero determina maggiori outcome (QALY) e minori costi di trattamento rispetto a non trattare questi soggetti. A fronte di ulteriori incrementi della percentuale di sconto, l’alternativa terapeutica con DAAs diviene sempre più vantaggiosa rispetto al non trattare; per esempio, con uno sconto dell’80%, il costo medio di trattamento con DAAs (terapia farmacologica, monitoraggio e gestione dell’HCV) sarebbe pari a € 13.402,02 (di cui € 7.292,23 per la terapia farmacologica) rispetto agli € 26.118,78 generati dalla sola gestione dell’evoluzione dell’HCV in caso di assenza di trattamento.

Discussione
La disponibilità dei regimi DAAs, caratterizzati da somministrazione orale e da una breve durata di trattamento rappresenta un’importante opportunità per il trattamento di popolazioni difficili da “raggiungere” come i carcerati, nei quali la prevalenza dell’HCV è molto alta (11).
L’impatto economico dei DAAs nel trattamento della popolazione genarle con HCV è stato analizzato in molteplici analisi e la maggior parte di queste ne ha determinato la costo-efficacia (23,40,41,42,43,44,45,46). Al contrario, sono limitate le pubblicazioni che hanno valutato l’utilizzo dei DAAs nella popolazione carceraria e, a oggi, nessuna riferita al contesto italiano. Il presente lavoro costituisce, quindi, un primo esempio di valutazione dell’impatto clinico ed economico dei DAAs nel lungo termine in questo specifico setting di pazienti. Il modello di Markov, attraverso una semplice e trasparente rappresentazione del percorso clinico del paziente con HCV, ha permesso di stimare, lungo un periodo lifetime, il rapporto di costo-efficacia della strategia che prevede il trattamento dei carcerati con DAAs rispetto a una strategia alternativa, che, invece, non prevede alcun trattamento. Nel caso base, nella prospettiva del SSN, a fronte di un migliore outcome (QALY) e di un maggior costo di trattamento, la strategia con DAAs è risultata costo-efficace con un ICER per QALY di € 3.010,07, ampiamente al di sotto del valore soglia di € 40.000 comunemente accettato in Italia (39). Tale risultato è determinato dal fatto che i maggiori costi associati alla somministrazione e al monitoraggio dei DAAs sono in parte compensati dai costi associati ai pazienti non trattati per gestire la progressione della malattia epatica. In quest’ottica, l’investimento fatto dal SSN per garantire l’accesso ai DAAs per i detenuti con HCV sarebbe, nel lungo termine, costo-efficace rispetto alla strategia di non trattare.
È importante sottolineare il fatto che, nel caso base, è stato considerato, per i regimi DAAs, un costo medio di trattamento ricavato dalla media dei rispettivi prezzi ex-factory al netto delle sole riduzioni obbligatorie di legge per un importo di € 37.000. In realtà, tale valore non rispecchia l’attuale prezzo di cessione a carico delle strutture ospedaliere/SSN. Per questo motivo, è stata condotta un’analisi di scenario, facendo variare, rispetto al caso base, il costo medio farmacologico dei DAAs rispetto a una serie di scaglioni progressivi di sconto (dal 20% all’80%). Si è visto che, già a fronte di uno sconto del 45%, l’opzione con DAAs diventerebbe dominante, ovvero i costi di trattamento sarebbero inferiori rispetto a quelli che si avrebbero in caso di assenza di trattamento farmacologico. Continuando ad aumentare lo sconto verso uno scenario sempre più realistico, si nota come la somministrazione dei DAAs alla popolazione carceraria HCV RNA positiva diventerebbe cost-saving, ovvero, a fronte di un migliore outcome (QALY), determinerebbe minori costi di trattamento rispetto all’opzione di non trattare. Tale risultato sottolinea la convenienza economica e clinica della somministrazione dei DAAs nella popolazione carceraria HCV RNA positiva.
I tre regimi DAAs qui considerati sono caratterizzati da un’elevata efficacia e da un eccellente profilo di sicurezza, che consente a qualsiasi paziente di essere candidato a ricevere il trattamento antivirale per eliminare l’infezione da HCV. Sulla base della letteratura, abbiamo assunto nel modello un tasso di SVR del 98%, indipendentemente dal regime somministrato, dal genotipo e dal grado di fibrosi. Infatti, al posto di considerare nel modello una serie di differenti strategie di trattamento, è stato assunto che, per ogni singolo paziente, venga adottato il miglior regime DAAs in funzione del genotipo, dello stadio della malattia e della storia clinica, determinando, così, i migliori risultati di efficacia (SVR) (21-32). La validità di tale assunzione è stata, poi, testata nell’analisi di sensibilità, ipotizzando una sensibile riduzione della SVR (78%), soprattutto per simulare la criticità dell’assistenza sanitaria alla popolazione carceraria. Anche a fronte di tale variazione, l’utilizzo dei DAAs rimarrebbe sempre dominante.
La disponibilità dei DAAs ha imposto un cambiamento radicale nella gestione dell’HCV, così come ha sollevato problematiche di sostenibilità correlate alla spesa farmaceutica. Per rispondere a tale interrogativo e considerando la lunga durata della storia clinica di questi pazienti, è emersa la necessità di condurre analisi economiche lungo un periodo lifetime idoneo a catturarne tutti gli effetti e, soprattutto, tutti i costi. Si giustifica, così, il ricorso a modelli di simulazione in grado di estrapolare sul lungo periodo gli esiti clinici dei trial che spesso sono riferiti a un arco temporale di breve durata.
Un limite nell’utilizzo del presente modello di simulazione potrebbe risiedere nel fatto che i dati di input siano stati ricavati non da un’unica, ma da differenti pubblicazioni. Ciò costituisce, però, una prassi consolidata nelle valutazioni economiche, in quanto è spesso impossibile trovare un’unica fonte che contenga tutti i dati necessari per popolare un modello di simulazione. Si precisa, inoltre, che tutte le variabili considerate si riferiscono a pubblicazioni caratterizzate da un alto livello di evidenza clinica e che, grazie all’analisi di sensibilità (costo di trattamento dei DAAs, SVR, valori di utilità, probabilità di transizione e altri costi di trattamento), si è, poi, proceduto a indagarne l’eventuale incertezza.
A causa della mancanza di dati, è stato assunto nel modello che tutti i pazienti completino il trattamento, escludendo di fatto il ritrattamento in caso di fallimento. In realtà, nella pratica clinica, alcuni di questi pazienti potrebbero non completare la terapia a causa dell’interruzione del trattamento per una scarsa risposta virologica o della comparsa di effetti avversi, anche se questo scenario era tipico del periodo precedente ai DAAs, dove circa il 13-21% dei pazienti trattati non completava la terapia rispetto allo 0-2% con DAAs (23).
I presenti risultati possono, inoltre, essere confrontati con quelli di due recenti studi internazionali condotti negli Stati Uniti (47) e in Spagna (48). Lo studio americano ha stimato, anch’esso lungo un orizzonte temporale lifetime, l’efficacia e i costi di trattamento di due strategie di trattamento adottabili nella popolazione carceraria: nessun trattamento rispetto al trattamento dei soggetti HCV RNA positivi. La somministrazione di una terapia anti HCV determinerebbe un aumento della SVR del 23% e una riduzione del 54% dei casi di cirrosi, a fronte di un costo addizionale per detenuto di USD 1440. Gli autori concludono affermando che il trattamento dei detenuti HCV positivi rappresenti una strategia costo-efficace (47).
Lo studio spagnolo ha valutato la costo-efficacia della terapia con DAAs nella popolazione carceraria (48). Grazie a un modello di Markov sono state confrontate, lungo un orizzonte temporale lifetime, due differenti strategie di trattamento nella popolazione carceraria con HCV: la prima prevedeva la somministrazione dei farmaci DAAs, mentre la seconda non prevedeva la somministrazione di alcun trattamento. Il modello è stato popolato sulla base dei dati real-world di efficacia e di consumo di risorse sanitarie raccolti dal piano strategico per affrontare l’epatite C nei penitenziari predisposto dal sistema sanitario nazionale spagnolo. I risultati dello studio, in accordo con quanto trovato in questa sede, evidenziano la costo-efficacia della somministrazione del trattamento con DAAs rispetto all’assenza di trattamento. Anche in questo caso, i maggior costi farmacologici vengono compensati dai minori costi per la gestione del corso naturale della patologia (48).
Conclusioni
A conclusione dei risultati emersi da questo lavoro, è possibile affermare che l’adozione dei DAAs nella popolazione carceraria HCV positiva costituisca una scelta strategica in grado di efficientare l’onere economico della malattia a carico del SSN, in particolare se si considera che il trattamento dell’infezione da HCV nelle carceri è in linea con il concetto di “trattamento come prevenzione”, riducendo un potenziale serbatoio dell’infezione e, di conseguenza, la trasmissione della malattia dal sistema carcerario alla comunità.
Disclosures
Conflict of interest: The authors declare no conflict of interest.
Financial support: This research was made possible by an educational grant from Gilead.
Bibliografia
- 1. Chen SL, Morgan TR. The natural history of hepatitis C virus (HCV) infection. Int J Med Sci. 2006;3(2):47-52. CrossRef Medline
- 2. Lavanchy D. The global burden of hepatitis C. Liver Int. 2009;29(suppl 1):74-81. CrossRef Medline
- 3. Younossi ZM, Singer ME, Mir HM, Henry L, Hunt S. Impact of interferon free regimens on clinical and cost outcomes for chronic hepatitis C genotype 1 patients. J Hepatol. 2014;60(3):530-537. CrossRef Medline
- 4. Butt AA, Wang X, Moore CG. Effect of hepatitis C virus and its treatment on survival. Hepatology. 2009;50(2):387-392. CrossRef Medline
- 5. van der Meer AJ, Veldt BJ, Feld JJ, et al. Association between sustained virological response and all-cause mortality among patients with chronic hepatitis C and advanced hepatic fibrosis. JAMA. 2012;308(24):2584-2593. CrossRef Medline
- 6. Suwanthawornkul T, Anothaisintawee T, Sobhonslidsuk A, Thakkinstian A, Teerawattananon Y. Efficacy of second generation direct-acting antiviral agents for treatment naïve hepatitis C genotype 1: a systematic review and network meta-analysis. PLoS One. 2015;10(12):e0145953. CrossRef Medline
- 7. Pérez-Pitarch A, Guglieri-López B, Ferriols-Lisart R, Merino-Sanjuán M. A model-based meta-analysis of sofosbuvir-based treatments in chronic hepatitis C patients. Int J Antimicrob Agents. 2016;47(3):184-194. CrossRef Medline
- 8. Zhang J, Nguyen D, Hu KQ. Chronic hepatitis C virus infection: a review of current direct-acting antiviral treatment strategies. N Am J Med Sci (Boston). 2016;9(2):47-54. Medline
- 9. Kondili LA, Andreoni M, Alberti A, et al. Estimated prevalence of undiagnosed Hepatitis C virus infected individuals in Italy: a mathematical model to accurately measure HCV prevalence with a route of transmission granularity. AASLD ABSTRACTS (Poster). Hepatology. 2019.
- 10. Gardini I, Bartoli M, Conforti M, Mennini FS, Marcellusi A. Estimation of the number of HCV-positive patients in Italy. PLoS One. 2019;14(10):e0223668. CrossRef Medline
- 11. Ranieri R, Starnini G, Carbonara S, et al; SIMSPe Group. Management of HCV infection in the penitentiary setting in the direct-acting antivirals era: practical recommendations from an expert panel. Infection. 2017;45(2):131-138. CrossRef Medline
- 12. United Nations. 45/111 Basic principles for the treatment of prisoners, 1990. Online
- 13. Dublin declaration on HIV/AIDS in prisons in Europe and central Asia, 2004. Online
- 14. Bretschneider W, Elger BS. Expert perspectives on Western European prison health services: do ageing prisoners receive equivalent care? J Bioeth Inq. 2014;11(3):319-332. CrossRef Medline
- 15. Drummond MF, O’Brien BJ, Stoddart GL, et al. Methods for the economic evaluation of health care programmes. Oxford (UK). Oxford University Press. 2005.
- 16. Gruppo di lavoro AIES (coordinato da G. Fattore). Proposta di Linee Guida per la valutazione economica degli interventi sanitari in Italia. PharmacoEconomics – Italian Research Articles. 2009;11(2):83-93.
- 17. Ministero della Giustizia. Online (Accesso Dicembre 2019).
- 18. Stöver H, Meroueh F, Marco A, et al. Offering HCV treatment to prisoners is an important opportunity: key principles based on policy and practice assessment in Europe. BMC Public Health. 2019;19(1):30. CrossRef Medline
- 19. Babudieri S. Presentazione. Agorà penitenziaria 2019 XIX Congresso Nazionale SIMSPe-ONLUS. 4-5 ottobre 2019 Roma.
- 20. Ranieri R, Giuliani R. Presentazione. Infezione da HCV: l’importanza del test and treat. Agorà penitenziaria 2019 XX Congresso Nazionale SIMSPe-ONLUS. Il carcere è territorio. 3-4 ottobre 2019 Milano.
- 21. Pontali E, Fiore V, Ialungo AM, et al; Gruppo Infettivologi Penitenziari. Treatment with direct-acting antivirals in a multicenter cohort of HCV-infected inmates in Italy. Int J Drug Policy. 2018;59:50-53. CrossRef Medline
- 22. Foschi A, Casana M, Radice A, Ranieri R, d’Arminio Monforte A. Hepatitis C management in prisons: an insight into daily clinical practice in three major Italian correctional houses. Hepatology. 2016;64(5):1821-1822. CrossRef Medline
- 23. Turnes J, Domínguez-Hernández R, Casado MÁ. Cost-effectiveness analysis of two treatment strategies for chronic hepatitis C before and after access to direct-acting antivirals in Spain. Gastroenterol Hepatol. 2017 Aug Sep;40(7):433-446. Epub 2017 Jun 21. CrossRef
- 24. Chahal HS, Marseille EA, Tice JA, et al. Cost-effectiveness of early treatment of hepatitis C virus genotype 1 by stage of liver fibrosis in a US treatment-naive population. JAMA Intern Med. 2016;176(1):65-73. CrossRef Medline
- 25. Younossi ZM, Park H, Saab S, Ahmed A, Dieterich D, Gordon SC. Cost-effectiveness of all-oral ledipasvir/sofosbuvir regimens in patients with chronic hepatitis C virus genotype 1 infection. Aliment Pharmacol Ther. 2015;41(6):544-563. CrossRef Medline
- 26. San Miguel R, Gimeno-Ballester V, Blázquez A, Mar J. Cost-effectiveness analysis of sofosbuvir-based regimens for chronic hepatitis C. Gut. 2015;64(8):1277-1288. CrossRef Medline
- 27. Buti M, San Miguel R, Brosa M, et al. Estimating the impact of hepatitis C virus therapy on future liver-related morbidity, mortality and costs related to chronic hepatitis C. J Hepatol. 2005;42(5):639-645. CrossRef Medline
- 28. Maylin S, Martinot-Peignoux M, Moucari R, et al. Eradication of hepatitis C virus in patients successfully treated for chronic hepatitis C. Gastroenterology. 2008;135(3):821-829. CrossRef Medline
- 29. Saab S, Hunt DR, Stone MA, McClune A, Tong MJ. Timing of hepatitis C antiviral therapy in patients with advanced liver disease: a decision analysis model. Liver Transpl. 2010;16(6):748-759. CrossRef Medline
- 30. Ferrante SA, Chhatwal J, Brass CA, et al. Boceprevir for previously untreated patients with chronic hepatitis C Genotype 1 infection: a US-based cost-effectiveness modeling study. BMC Infect Dis. 2013;13(1):190. CrossRef Medline
- 31. Fattovich G, Giustina G, Degos F, et al. Morbidity and mortality in compensated cirrhosis type C: a retrospective follow-up study of 384 patients. Gastroenterology. 1997;112(2):463-472. CrossRef Medline
- 32. Heffernan A, Cooke GS, Nayagam S, Thursz M, Hallett TB. Scaling up prevention and treatment towards the elimination of hepatitis C: a global mathematical model. Lancet. 2019; 393(10178):1319-1329. CrossRef Medline
- 33. Elbasvir/grazoprevir. Online (Accesso dicembre 2019).
- 34. Sofosbuvir/velpatasvir. Online (Accesso dicembre 2019).
- 35. Glecaprevir/pibrentasvir. Online (Accesso dicembre 2019).
- 36. Nomenclatore dell’assistenza specialistica ambulatoriale. 28.01.2013 Supplemento ordinario n. 8 alla Gazzetta Ufficiale. Serie generale n.23. Online
- 37. Ruggeri M, Romano F, Basile M, et al. Cost-Effectiveness Analysis of Early Treatment of Chronic HCV with Sofosbuvir/Velpatasvir in Italy. Appl Health Econ Health Policy. 2018;16(5):711-722. CrossRef Medline
- 38. Ruggeri M, Rolli FR, Kondili LA, et al. Cost-effectiveness analysis of Daclatasvir/Sofosbuvir for the treatment of the HCV patients failed after the first line with second generation of DAAs in Italy. Expert review of pharmacoeconomics & outcomes research. 2019;19(3):363-374.
- 39. Fattore G. Gruppo di lavoro AIES (coordinato da G. Fattore). Proposta di Linee Guida per la valutazione economica degli interventi sanitari in Italia. PharmacoEconomics-Italian Research Articles. 2009;11(2):83-93. CrossRef
- 40. Puig-Junoy J, Pascual-Argente N, Puig-Codina L, Planellas L, Solozabal M. Cost-utility analysis of second-generation direct-acting antivirals for hepatitis C: a systematic review. Expert Rev Gastroenterol Hepatol. 2018;12(12):1251-1263. CrossRef Medline
- 41. Souliotis K, Siakavellas S, Golna C, Manesis E, Papatheodoridis G, Hatzakis A. Real-life cost of managing chronic HCV infection in Greece prior to Direct-Acting Antivirals (DAAs): an undeniable truth of spending more for less. Hippokratia. 2018;22(3):127-131. Medline
- 42. He T, Lopez-Olivo MA, Hur C, Chhatwal J. Systematic review: cost-effectiveness of direct-acting antivirals for treatment of hepatitis C genotypes 2-6. Aliment Pharmacol Ther. 2017;46(8):711-721. CrossRef Review. Medline
- 43. Aggarwal R, Chen Q, Goel A, et al. Cost-effectiveness of hepatitis C treatment using generic direct-acting antivirals available in India. PLoS One. 2017;12(5):e0176503. CrossRef Medline
- 44. Li X, Chan NS, Tam AW, Hung IFN, Chan EW. Budget impact and cost-effectiveness analyses of direct-acting antivirals for chronic hepatitis C virus infection in Hong Kong. Eur J Clin Microbiol Infect Dis. 2017;36(10):1801-1809. CrossRef Medline
- 45. Ciaccio A, Cortesi PA, Bellelli G, et al. Direct-acting antivirals combination for elderly patients with chronic hepatitis C: A cost-effectiveness analysis. Liver Int. 2017;37(7):982-994. CrossRef Medline
- 46. Chhatwal J, He T, Lopez-Olivo MA. Systematic Review of Modelling Approaches for the Cost Effectiveness of Hepatitis C Treatment with Direct-Acting Antivirals. Pharmacoeconomics. 2016;34(6):551-567. CrossRef Medline
- 47. Assoumou SA, Tasillo A, Vellozzi C, et al. Cost-effectiveness and budgetary impact of HCV testing, treatment and linkage to care in U.S. prisons. Clin Infect Dis. 2020;70(7):1388-1396. CrossRef Medline
- 48. Marco A, Domínguez-Hernández R, Casado MA. Análisis coste-efectividad del tratamiento de la hepatitis c crónica en población reclusa. Póster N° EI15. XII Congreso Nacional y XX Jornadas de la Sociedad Española de Sanidad Penitenciaria 2018.