 |
AboutOpen | 2020; 7(1): 67–73 ISSN 2465–2628 | DOI: 10.33393/abtpn.2020.2153 ORIGINAL RESEARCH ARTICLE |
 |
Valutazione economica delle citochine a basso dosaggio nel trattamento di mantenimento in pazienti con artrite reumatoide a bassa attività di malattia o in remissione
Economic evaluation of low-dose SKA cytokines in patients with rheumatoid arthritis in maintaining low disease activity or remission
Introduction: The administration of low-dose SKA (Sequential Kinetic Activation technology) cytokines allows to maintain remission or low disease activity in patients with rheumatoid arthritis. This analysis aims to estimate the maintenance treatment cost of low-dose SKA cytokines versus DMARDs in patients with rheumatoid arthritis.
Methods and Results: Rather than evaluating the cost-effectiveness of individual therapeutic agents, it becomes recommendable for decision-makers to identify an optimal sequencing of such agents. A one-year cost-consequence analysis (CCA) was conducted, comparing two alternative strategies to maintain remission or low disease activity in patients with rheumatoid arthritis: i) first line with low-dose SKA cytokines and second line with anti tumor necrosis factor-α (anti-TNF-α), ii) first line with DMARDs and second line with anti-TNF-α. The CCA was conducted from the perspective of the Italian National Health Service (iNHS). Only direct medical costs (drugs cost) were considered. We performed a sensitivity analysis to test the robustness of the results. The sequence using cytokines in first line showed the lower mean annual cost of treatment: the mean annual cost per patient was €1,280.96 with cytokines and €1,987.21 with DMARDs. Sensitivity analyses confirmed the base case result.
Conclusion: From the iNHS’s perspective, low-dose SKA cytokines as first line treatment appears a cost-saving strategy to maintain remission or low disease activity in patients with rheumatoid arthritis.
Keywords: Cost, Italian NHS, Low-dose SKA cytokines, Maintenance, Rheumatoid arthritis
Received: May 26, 2020
Accepted: July 1, 2020
Published online: September 1, 2020
© 2020 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Any commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
L’artrite reumatoide (AR) è una malattia infiammatoria cronica di origine autoimmune caratterizzata da una sinovite persistente che determina progressivamente la distruzione della cartilagine e l’erosione dell’osso, con conseguenti deformazioni articolari e disabilità (1,2). In Italia si stima che circa lo 0,5% della popolazione adulta soffra di AR (3).
La terapia standard è costituita dai farmaci antireumatici convenzionali modificanti la malattia (conventional synthetic disease-modifying antirheumatic drugs, csDMARDs), ad esempio metotrexato, leflunomide o ciclosporina. Con l’obiettivo di avere una risposta clinica più efficace e di ridurre la disabilità nel lungo periodo, in questi anni l’approccio terapeutico è stato indirizzato verso l’utilizzo dei farmaci antireumatici biologici modificanti la malattia (biological disease-modifying antirheumatic drugs, bDMARDs) (4,5,6,7,8), quali, ad esempio, i farmaci anti tumor necrosis factor-α (anti-TNF-α) o gli inibitori selettivi degli enzimi JAK1/JAK2. I bDMARDs costituiscono una valida alternativa, raccomandata soprattutto nei pazienti con risposta inadeguata o intolleranti ai csDMARDs o per i quali sia inappropriato continuare un trattamento con csDMARDs (9,10). Sono, tuttavia, emerse alcune prime evidenze circa una possibile perdita di efficacia nel tempo dei bDMARDs (11).
Un quesito clinico, a cui non è stata data ancora una risposta, è sapere per quanto tempo il paziente debba assumere i bDMARDs e soprattutto se, nelle prime fasi della malattia, una volta ottenuta la remissione o una bassa attività della malattia (low disease activity, LDA), sia corretto sospenderne la somministrazione.
In tale contesto, diventa fondamentale identificare corrette strategie terapeutiche che possano mantenere nel tempo la remissione o una LDA dell’AR.
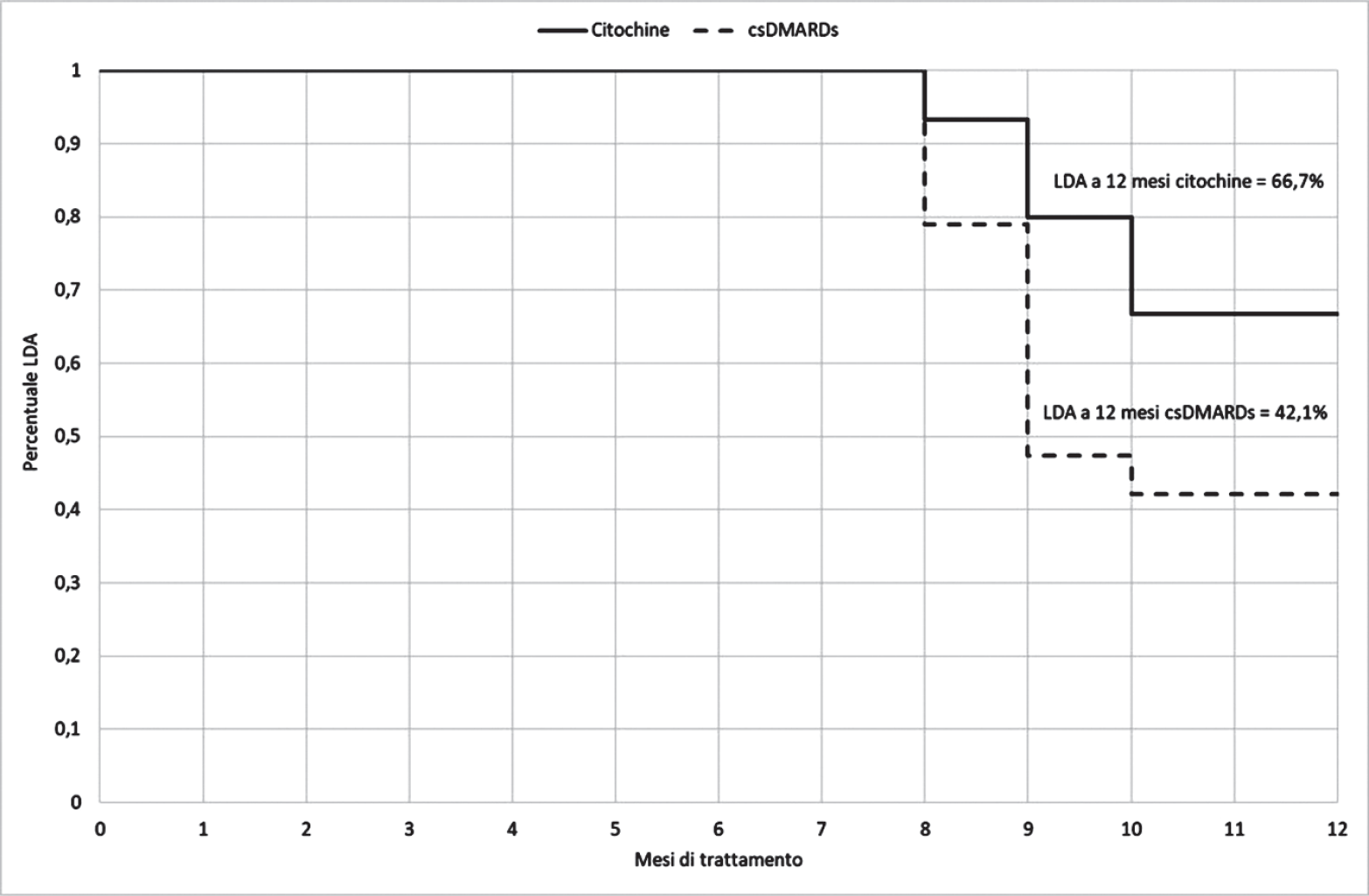
Oltre alla terapia convenzionale (csDMARDs) o biologica (bDMARDs), le citochine antinfiammatorie a basso dosaggio (10 fg/mL), somministrate per via orale, prodotte con tecnologia Sequential Kinetic Activation (SKA), rappresentano un’ulteriore opzione nel trattamento di mantenimento in pazienti con AR a bassa attività di malattia o in remissione (12,13). A differenza dei bDMARDs, per i quali non sarebbe praticabile l’uso contemporaneo di più di un farmaco biologico a dosaggio standard a causa di gravi effetti collaterali, più citochine a basso dosaggio possono essere invece somministrate allo stesso tempo senza causare effetti collaterali tali da interrompere la terapia (14). Seguendo questo approccio, lo studio condotto da Martin-Martin e colleghi ha valutato, rispetto alla terapia con csDMARDs, la combinazione di tre citochine a basso dosaggio nel trattamento di mantenimento di pazienti con AR con LDA o in remissione dopo 6-8 mesi di trattamento con terapia biologica o convenzionale (15). A 12 mesi di osservazione, il 66,7% dei pazienti trattati con la combinazione di citochine ha mantenuto una LDA, mentre tale percentuale è scesa al 42,1% nei pazienti trattati con csDMARDs (15). Lo studio ha evidenziato inoltre un buon profilo di tollerabilità per entrambi i gruppi, senza riportare gravi effetti collaterali (15).
Obiettivo
Poiché nei pazienti con AR con LDA o in remissione e in trattamento con csDMARDs la progressione della malattia è un evento probabile (16), è altrettanto possibile che gli stessi pazienti possano essere sottoposti a una successiva terapia biologica. In termini di sostenibilità economica, diventa quindi rilevante ottimizzare il percorso terapeutico per questi pazienti, definendo quale sequenza di trattamenti possa essere la più efficiente.
Perciò, sulla base dei risultati dello studio condotto da Martin-Martin e colleghi (15), la presente analisi economica ha verificato se l’utilizzo di una sequenza che prevede, nei pazienti con AR con LDA o in remissione, la somministrazione della combinazione di tre citochine (IL-4, IL-10 e anti-IL-1) a basso dosaggio (10 fg/mL) quale prima linea di trattamento, determini un’allocazione più efficiente delle risorse rispetto a una sequenza alternativa che prevede invece, in prima linea, la somministrazione dei csDMARDs. Il focus dell’analisi non è quindi un confronto tra molecole, bensì tra differenti percorsi di trattamento.
Materiali e metodi
Tecnica di analisi
Poiché la presente valutazione economica ha come oggetto la stima del costo di due differenti percorsi di trattamento, la tecnica di analisi più appropriata è la cost-consequence analysis (CCA). Con essa viene calcolato il semplice impatto economico dei costi e degli effetti di un percorso di trattamento (17). La CCA offre una più completa presentazione delle informazioni riguardanti il value di una terapia farmacologica o di un qualsiasi altro intervento sanitario (17).
Dati clinici
La presente CCA poggia le proprie basi cliniche sui risultati dello studio randomizzato, di fase IV, condotto da Martin-Martin e colleghi (15). Lo studio ha valutato il tasso di mantenimento di LDA dell’AR a 12 mesi (primary endpoint) associato alla somministrazione di una combinazione di tre citochine (IL-4, IL-10 e anti-IL-1) a basso dosaggio (10 fg/mL) rispetto alla terapia convenzionale con csDMARDs. Sono stati considerati pazienti con:
1. diagnosi di AR in accordo ai criteri ACR (American College of Rheumatology) (18),
2. età ≥ 18 anni,
3. durata della malattia inferiore a 3 anni,
4. punteggio DAS28 (disease activity score di 28 articolazioni) <3,2 dopo terapia con biologico o con csDMARDs,
5. con AR con LDA o in remissione dopo trattamento con biologico e/o csDMARDs,
6. assenza di comorbilità tali da controindicare una terapia con biologici o immunosoppressori.
Tra luglio 2011 e marzo 2014, presso l’Ospedale San Pietro Fatebenefratelli di Roma, sono stati selezionati 52 pazienti, di cui 13 esclusi (rifiuto a partecipare o criteri di inclusione non soddisfatti), per un totale di 39 arruolati. Di questi, 19 sono stati randomizzati a prendere le citochine e 20 i csDMARDs. Ogni paziente, a partire dalla data di arruolamento, è stato visitato ogni 3 mesi lungo un orizzonte temporale di 12 mesi al fine di valutare parametri clinici quali DAS28, CDAI (clinical disease activity index), GHA (global health assessment) ed effettuare testi di laboratorio quali fattore reumatoide e proteina C reattiva. Durante questo arco temporale 5 pazienti (4 nel gruppo citochine e 1 nel gruppo csDMARDs) hanno abbandonato lo studio per interruzione del trattamento. La Tabella I presenta le principali caratteristiche demografiche e cliniche all’arruolamento dei 34 pazienti che hanno concluso lo studio. A 12 mesi il 66,7% dei pazienti trattati con citochine e il 42,1% di quelli trattati con csDMARDs hanno mantenuto una LDA dell’AR (Figura 1). Nessun evento avverso è stato riportato in entrambi i gruppi.
| Parametri | Citochine | csDMARDs |
|---|---|---|
| Pazienti (n) | 15 | 19 |
| Età (anni ± DS) | 47,08 ± 11,11 | 63,3 ± 11,48 |
| Femmine (%) | 92,85 | 85,71 |
| Durata della malattia (anni ± DS) | 2,58 ± 1,62 | 2,56 ± 0,82 |
| Precedente terapia con csDMARDs (n – %) | 2/15 – 13,3% | 3/19 – 15,8% |
| Precedente terapia con bDMARDs (n – %) | 13/15 – 86,7% | 16/19 – 84,2% |
| DAS28 | 2,62 | 2,46 |
| CDAI | 6,14 | 2,80 |
| SDAI | 4,99 | 2,23 |
| Swollen joints | 0,50 | 0,14 |
| Tender joints | 1,33 | 1,14 |
| GHA | 21,56 | 16,50 |
| ESR (mm/h) | 13,67 | 14,26 |
| CRP (mg/dL) | 0,70 | 2,18 |
| RF | 50,85 | 83,78 |
| VAS (0-10) | 3,38 | 3,08 |
DAS = disease activity score; CDAI = clinical disease activity index; SDAI = simplified disease activity index; GHA = global health assessment; ESR = erythrocyte sedimentation rate; CRP = C-reactive protein; RF = rheumatoid factor; VAS = visual analog scale; DS = deviazione standard.
Popolazione target
La popolazione considerata nella presente CCA riflette quella arruolata dallo studio clinico condotto da Martin-Martin e colleghi (15); ovvero pazienti con una storia clinica di AR inferiore a 3 anni in remissione o con LDA dopo 8-6 mesi di trattamento con terapia biologica e/o convenzionale.
Orizzonte temporale
In linea con lo studio clinico di riferimento (15) è stato considerato un orizzonte temporale di 12 mesi. Si ritiene che tale periodo sia sufficiente per identificare eventuali differenze tra le prime linee di trattamento (citochine o csDMARDs), espresse, in caso di fallimento (progressione dell’AR), in termini di tempo all’inizio della successiva (seconda) linea di trattamento con i biologici. Una maggiore permanenza del paziente nella prima linea di trattamento non può che riflettersi positivamente sullo stato di salute del paziente e, conseguentemente, essere correlata a un minore consumo di risorse (trattamento farmacologico).
Trattamenti
In relazione alla popolazione target (15), le due alternative per la prima linea di trattamento sono i csDMARDs o la combinazione di citochine. In caso di fallimento, indipendentemente dal trattamento adottato in prima linea, la sequenza qui ipotizzata prevede la somministrazione di una seconda linea con farmaci biologici. La scelta è ricaduta sugli anti-TNF-α adalimumab, etanercept, infliximab, certolizumab pegol e golimumab, in quanto costituiscono la terapia biologica somministrata nello studio clinico di riferimento ai pazienti per raggiungere una LDA o la remissione dell’AR (15). È quindi plausibile assumere che, in caso di progressione della malattia, ai pazienti vengano somministrati i farmaci biologici rivelatisi efficaci già in precedenza (15).
Sequenze di trattamento
L’analisi delle sequenze di trattamento è imperniata sulla duration of treatment (DOT), ovvero il tempo medio intercorso tra l’inizio della prima e l’inizio della successiva (seconda) linea di trattamento. La Figura 2, sulla base dei risultati dello studio clinico (15) e dell’orizzonte temporale adottato (12 mesi), mostra per ognuna delle prime linee di trattamento considerate (citochine e csDMARDs) il tempo medio al successivo trattamento e i mesi residuali di esposizione alla seconda linea di trattamento (farmaco biologico).
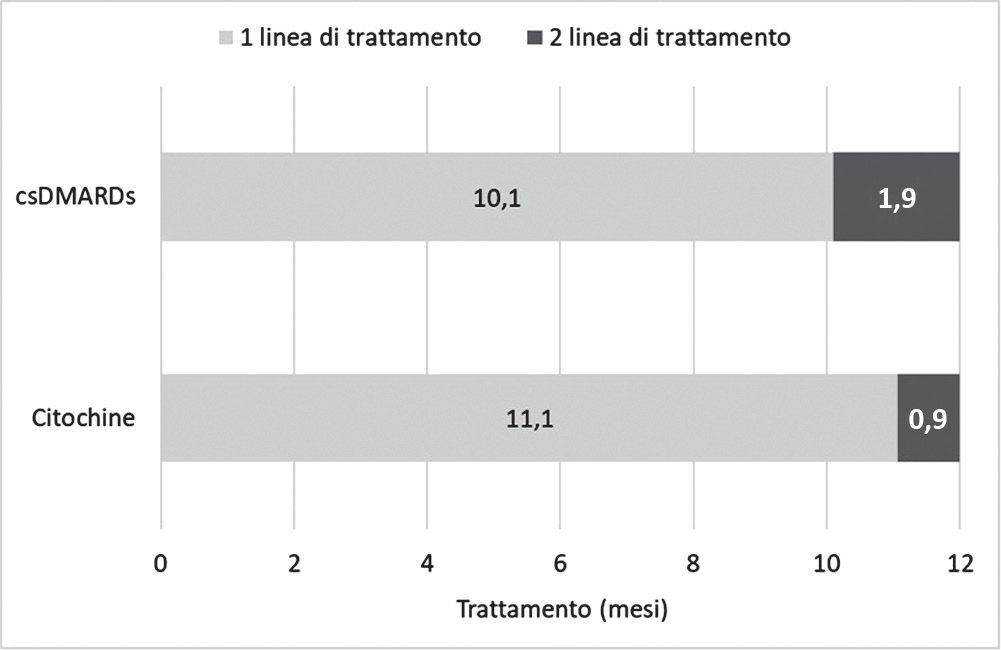
Se la prima linea di trattamento viene effettuata con citochine, il paziente, sulla base dell’efficacia media attesa (15), ricorre alla seconda linea di trattamento (biologico) dopo 11,1 mesi. Differentemente, se il paziente inizia la terapia con csDMARDs, ricorre alla seconda linea di trattamento (biologico) dopo 10,1 mesi. La DOT della seconda linea va dalla fine della prima linea di trattamento fino alla fine del periodo di osservazione (12 mesi); nello specifico, 0,9 mesi in caso di somministrazione di citochine o 1,9 mesi in caso di somministrazione di csDMARDs. L’osservazione si conclude nei 12 mesi.
Prospettiva di analisi
La CCA è stata condotta nella prospettiva del Servizio Sanitario Nazionale (SSN) considerando i soli costi diretti sanitari determinati dai regimi somministrati per il trattamento dei pazienti con AR con LDA o in remissione. In particolare, sia per la prima che per la seconda linea di trattamento sono stati considerati i soli costi di acquisto delle terapie farmacologiche, escludendo tutte le altre fonti di costo legate alla somministrazione dei farmaci o alla gestione degli eventi avversi correlati.
Costi di trattamento
La Tabella II riporta in dettaglio per ognuno dei farmaci considerati il relativo costo per mese di trattamento, calcolato sulla base dei dosaggi di somministrazione indicati nello studio clinico (15) o dei rispettivi Riassunti delle Caratteristiche del Prodotto) (RCP) (19,20,21,22,23) e del relativo costo per unità posologica.
Lo schema posologico adottato per la combinazione delle tre citochine prevede la somministrazione orale di ognuna di esse alla dose di 20 gocce/die per 12 mesi, fatta eccezione per 2 pazienti a cui è stato aggiunto metotrexato (MTX) sottocute (sc) alla dose settimanale di 15 mg (15). Dei 19 pazienti del gruppo csDMARDs, 15 hanno ricevuto la dose settimanale di 15 mg di MTX sc, 2 pazienti, oltre a MTX sc, hanno ricevuto 400 mg/die di idrossiclorochina solfato, 1 paziente in aggiunta a MTX sc ha ricevuto 200 mg/die di ciclosporina e, infine, 1 paziente è stato trattato con il solo leflunomide alla dose di 20 mg/die (15). Per MTX, ciclosporina e leflunomide è stato considerato il prezzo di cessione al SSN così come indicato dalla lista di trasparenza dei farmaci equivalenti (Febbraio 2020) (24). Per l’idrossiclorochina solfato è stato invece considerato il relativo prezzo al pubblico. Poiché a differenza dei csDMARDs qui considerati le citochine non sono attualmente rimborsate dal SSN, si è assunto che l’attuale prezzo al pubblico corrispondesse al prezzo a carico del SSN nel caso in cui tali specialità farmaceutiche fossero rimborsate.
Nel caso base lo schema di somministrazione dei farmaci biologici riflette i rispettivi dosaggi di mantenimento (Tab. II), non considerando che per alcuni di essi (infliximab e certolizumab) l’avvio della terapia è caratterizzato da una dose di carico (19,20,21,22,23). Per ciascuno dei farmaci biologici è stato considerato il rispettivo prezzo ex-factory; in particolare per adalimumab, etanercept e infliximab è stato considerato il prezzo ex-factory del corrispondente biosimilare.
| Specialità | Unità per confezione | Costo per confezione (€) | Posologia | Costo per mese di trattamento (€)* | Prezzo |
|---|---|---|---|---|---|
| Citochine | |||||
| Interleuchina 4 | 1 flacone 30 ml | 14,90 | 20 gtt/die | 14,90 | Prezzo al pubblico |
| Interleuchina 10 | 1 flacone 30 ml | 14,90 | 20 gtt/die | 14,90 | Prezzo al pubblico |
| Anti-Interleuchina 1 | 1 flacone 30 ml | 14,90 | 20 gtt/die | 13,40 | Prezzo al pubblico |
| csDMARDs | |||||
| Metotrexato | 4 siringhe 15 mg | 40,52 | 15 mg ogni settimana | 43,41 | Prezzo cessione SSN** |
| Ciclosporina | 30 cps 100 mg | 55,34 | 200 mg/die | 110,68 | Prezzo cessione SSN** |
| Idrossiclorochina solfato | 30 cpr 200 mg | 6,08 | 400 mg/die | 12,16 | Prezzo al pubblico |
| Leflunomide | 30 cpr 20 mg | 56,14 | 20 mg/die | 56,14 | Prezzo cessione SSN** |
| bDMARDs | |||||
| Adalimumab*** | 2 penne 40 mg | 684,71 | 40 mg ogni 2 settimane | 733,62 | Prezzo ex-factory |
| Etanercept*** | 4 penne 25 mg | 299,34 | 25 mg 2 volte a settimana | 641,44 | Prezzo ex-factory |
| Infliximab***^ | 1 flacone 100 mg | 386,28 | 3 mg/kg ogni 8 settimane | 434,57 | Prezzo ex-factory |
| Certolizumab | 2 penne 200 mg | 920,55 | 200 mg ogni 2 settimane | 986,30 | Prezzo ex-factory |
| Golimumab | 1 penna 50 mg | 1.044,19 | 50 mg 1 volta al mese | 1.044,19 | Prezzo ex-factory |
*Il costo medio mensile di trattamento è calcolato su 30 giorni.
**Lista di trasparenza farmaci equivalenti Febbraio 2020.
***È stato considerato il prezzo ex-factory del biosimilare.
^Per stimare la dose da somministrare al paziente è stato considerato un peso medio corporeo di 70 kg.
Analisi di scenario
In aggiunta al caso base vengono presentati altri scenari finalizzati a valutare la variabilità dei risultati. In un primo caso è stato valutato l’impatto delle dosi di carico di infliximab e certolizumab sul costo medio di trattamento. In un secondo caso è stato invece ipotizzato che, a fronte del fallimento della prima linea, i pazienti vengano trattati con i soli biosimilari di adalimumab, etanercept o infliximab. Infine nel terzo e ultimo scenario è stato assunto che, dopo fallimento della prima linea, i pazienti vengano trattati con farmaci biologici caratterizzati da un differente meccanismo d’azione rispetto a quello degli anti-TNF-α, quali abatacept o tocilizumab. Sulla base del dosaggio indicato dalla rispettiva RCP (25,26) e del relativo prezzo ex-factory, è stato calcolato un costo medio mensile di trattamento di €1.038,21 per abatacept e di €961,84 per tocilizumab.
Risultati
Scenario Base
La Figura 3 illustra i risultati dell’analisi di cost-consequence per le citochine o i csDMARDs nel trattamento dei pazienti con AR con LDA o in remissione. A 1 anno, grazie a un maggiore arco temporale che intercorre tra l’inizio della prima e della successiva (seconda) linea di trattamento, la sequenza che inizia con la somministrazione delle citochine determina il minore costo medio di trattamento (€1.280,96) rispetto alla sequenza che inizia con l’uso dei csDMARDs (€1.987,21). La riduzione del costo annuo associata all’utilizzo delle citochine è di €706,25 (–35,5%).
Analisi di scenario
La Tabella III descrive i risultati delle tre analisi di scenario. Rispetto ai €706,25 del caso base, l’adozione della dose di carico o della terapia biologica con abatacept o tocilizumab determina un incremento del minor costo medio di trattamento della sequenza con citochine a €818,73 e a €929,25, rispettivamente. L’uso dei biosimilari, quale seconda linea di trattamento, determina invece una riduzione del minor costo medio di trattamento della sequenza con citochine pari a €547,80 rispetto ai €706,25 del caso base.

| Costo medio trattamento | |||
|---|---|---|---|
| 1 linea | 2 linea | Totale | |
| Scenario base | |||
| A) csDMARDs | € 532,01 | € 1.455,20 | € 1.987,21 |
| B) citochine | € 564,14 | € 716,82 | € 1.280,96 |
| B-A | –€ 706,25 | ||
| Scenario dose di carico | |||
| A) csDMARDs | € 532,01 | € 1.777,19 | € 2.309,20 |
| B) citochine | € 564,14 | € 926,33 | € 1.490,47 |
| B-A | –€ 818,73 | ||
| Scenario biosimilari | |||
| A) csDMARDs | € 532,01 | € 1.142,92 | € 1.674,93 |
| B) citochine | € 564,14 | € 562,99 | € 1.127,13 |
| B-A | –€ 547,80 | ||
| Scenario abatacept o tocilizumab | |||
| A) csDMARDs | € 532,01 | € 1.894,74 | € 2.426,75 |
| B) citochine | € 564,14 | € 933,36 | € 1.497,50 |
| B-A | –€ 929,25 | ||
Discussione
Nonostante siano orientati al solo costo dei farmaci, i risultati della presente analisi possono offrire ai decisori le basi per una riflessione economico-sanitaria sulla strategia nel trattamento di mantenimento dei pazienti con AR in remissione o con LDA. Di fronte alla possibilità che per questi pazienti l’AR possa peggiorare nel corso del tempo, diventa importante identificare quale sequenza di trattamento sia in grado di conseguire il beneficio clinico maggiore in rapporto al costo sostenuto. Acquista così maggiore importanza l’analisi di una sequenza terapeutica piuttosto che il confronto tra singoli trattamenti. In quest’ottica, la permanenza nella prima linea di trattamento (DOT) acquisisce un ruolo primario, poiché determina le quantità di farmaci somministrate lungo tutto il periodo di osservazione considerato. Tra le due sequenze analizzate, a fronte di un minor ricorso alla terapia biologica, quella con le citochine determina il minore costo medio di trattamento a 12 mesi (citochine: €1.280,96 vs csDMARDs: €1.987,21).
La presente CCA simula, per quanto realistico (poiché poggia le proprie basi sui risultati di uno studio clinico (15)), un ipotetico scenario nel quale dopo il fallimento della prima linea di trattamento con citochine o csDMARDs il paziente riceve un farmaco biologico. Poiché trattasi di una simulazione è opportuno discutere alcune assunzioni qui adottate. Un primo aspetto riguarda la scelta dell’orizzonte temporale di 12 mesi. Tale scelta è obbligata in quanto riflette l’orizzonte temporale adottato dallo studio clinico per valutare l’endpoint primario (percentuale di pazienti con LDA) (15). L’eventuale estrapolazione dei risultati clinici lungo un orizzonte temporale più ampio (24 o 36 mesi) non sarebbe stata corretta. Ciò avrebbe, infatti, implicato o il mantenimento nei successivi mesi di osservazione dello stesso tasso di interruzione annuo riportato dallo studio clinico (15) o l’adozione di un trend costante di crescita della percentuale dei pazienti che interrompono la prima linea di trattamento, estrapolato dall’endpoint primario dello studio clinico (15). Si ritiene invece che l’orizzonte temporale di un anno sia più che sufficiente per catturare, a seconda della prima linea adottata, il ritardo del passaggio alla seconda linea.
Il tempo al successivo trattamento, calcolato grazie alla percentuale di pazienti che a 12 mesi presentano un basso livello di attività dell’AR (15), rappresenta il parametro chiave della CCA. Purtroppo, ad oggi, non è possibile riscontrare il risultato ottenuto dallo studio condotto da Martin-Martin e colleghi (15) con quello di altre analisi pubblicate in letteratura. In un prossimo futuro, a conferma dei presenti risultati, sarà auspicabile il confronto con altre esperienze.
Differentemente dai csDMARDs, le citochine a basso dosaggio non sono rimborsate dal SSN. Al fine quindi di garantire un confronto omogeneo tra le alternative considerate, è stato assunto che l’attuale prezzo al pubblico delle citochine fosse uguale a quello a carico del SSN in caso di rimborsabilità delle stesse. Senza tale assunzione le citochine, di fatto, non costituirebbero un costo a carico del SSN, rendendo il confronto poco significativo. È però interessante osservare come il minore ricorso nei 12 mesi alla terapia biologica del paziente in trattamento con citochine (–€738,38) coprirebbe ampiamente il costo medio annuo di trattamento associato alle citochine stesse (€564,14). Quindi, anche nell’ipotesi in cui l’ospedale dovesse far fronte all’acquisto delle citochine (poiché non rimborsate), il risparmio associato alla terapia biologica renderebbe tale sequenza economicamente vantaggiosa per l’ospedale.
Come indicato nella sezione Metodi, la scelta della terapia biologica è ricaduta sui farmaci anti-TNF-α indicati dallo studio clinico (15), escludendo di fatto altre terapie biologiche, attualmente disponibili, caratterizzate da differenti meccanismi d’azione. L’analisi di scenario ha cercato, almeno in parte, di porre rimedio a tale lacuna, ipotizzando un ulteriore caso in cui nella seconda linea di trattamento vengono somministrati, ad esempio, abatacept o tocilizumab. Anche considerando questi farmaci, il risultato dell’analisi non cambierebbe, evidenziando sempre un minore costo di trattamento per la sequenza con citochine. Tale risultato è spiegato dal fatto che il principale driver della CCA è costituito dal tempo di permanenza in prima linea e non solo dal costo del trattamento biologico. Anche gli altri due scenari ipotizzati (inclusione delle dosi di carico o adozione di una seconda linea con biosimilare) confermano il risultato del caso base, individuando nella sequenza con citochine l’alternativa cost-saving. In questi casi appare evidente come, in riferimento al caso base, aumentando (dosi di carico) o diminuendo (biosimilari) il costo medio mensile del trattamento con biologico, rispettivamente, aumenti o diminuisca il minore costo medio annuo di trattamento delle citochine rispetto ai csDMARDs.
Nella presente analisi, in quanto ritenuti minimi, non sono stati volutamente considerati i costi di somministrazione e di eventuali eventi avversi associati alla terapia biologica somministrata, oppure, quando presenti, i costi di MTX in associazione alla terapia biologica. Se viceversa ciò fosse stato fatto, tali costi, seppur minimi, avrebbero aumentato il differenziale di costo a favore delle citochine, grazie a una maggiore permanenza di queste ultime nella prima linea di trattamento caratterizzata da minori costi rispetto alla seconda linea con biologico.
Conclusioni
In conclusione si può affermare, al di là dei limiti sopra esposti, che il ricorso alle citochine costituisca una valida strategia di ottimizzazione dell’impiego delle risorse sanitarie associate al trattamento di mantenimento dei pazienti con artrite reumatoide a bassa attività di malattia o in remissione. Inoltre, nell’ottica di definizione del budget di un reparto, sapere il momento in cui al paziente probabilmente dovrà essere somministrata una seconda linea di trattamento ha un importante significato in termini di programmazione e di sostenibilità della spesa.
Ringraziamenti
Questa ricerca è stata supportata da un grant educazionale messo a disposizione da Guna S.p.A.
Disclosures
Conflict of interest: None of the authors has financial interest related to this study to disclose.
Financial support: This research was made possible by an educational grant from Guna S.p.A.
Bibliografia
- 1. Gibofsky A. Epidemiology, pathophysiology, and diagnosis of rheumatoid arthritis: A Synopsis. Am J Manag Care. 2014 May;20(7 Suppl):S128-35.
- 2. Gibofsky A. Overview of epidemiology, pathophysiology, and diagnosis of rheumatoid arthritis. Am J Manag Care. 2012 Dec;18(13 Suppl):S295-302.
- 3. Rossini M, Rossi E, Bernardi D et al. Prevalence and incidence of rheumatoid arthritis in Italy. Rheumatol Int. 2014;34:659-64. Doi: 10.1007/s00296-014-2974-6.
- 4. Nell VP, Machold KP, Ebrel G et al. Benefit of very early referral and very early therapy with disease-modifying anti-rheumatic drugs in patients with early rheumatoid arthritis. Rheumatology. 2004;43:906-14.
- 5. Emery P, Breedveld FC, Dougados M et al. Early referral recommendation for newly diagnosed rheumatoid arthritis: evidence-based development of a clinical guide. Ann Rheum Dis. 2002;61:290-7.
- 6. Kuek A, Hazleman BL, Östor AJK. Immune mediated inflammatory diseases (IMIDs) and biologic therapy: a medical revolution. Postgrad Med J. 2007;83:251-60.
- 7. Lee DM, Weinblatt ME. Rheumatoid arthritis. Lancet. 2001:358:903-11.
- 8. Caporali R, Conti F, Alivernini S et al. Recommendations for the use of biologic therapy in rheumatoid arthritis: update from the Italian Society for Rheumatology I. Efficacy. Clin Exp Rheumatol. 2011;29(Suppl. 66):S7-S14.
- 9. Thwaites C, Finney A. Rheumatoid arthritis. 2: Exploring treatment options to achieve early control and remission. Nurs Times. 2010;106(10):18-20.
- 10. National Institute for Health and Clinical Excellence. Rheumatoid arthritis (CG79): full guideline. London, UK: NICE; 2009. http://guidance.nice.org.uk/CG79/Guidance.
- 11. Strehblow C, Haberhauer G, Fasching P. Comparison of different biologic agents in patients with rheumatoid arthritis after failure of the first biologic therapy. Wien Med Wochenschr. 2010;160(9-10):225-9.
- 12. Burska A, Boissinot M, Ponchel F. Cytokines as biomarkers in rheumatoid arthritis. Mediators Inflamm. 2014;2014:545493.
- 13. Venkatesha SH, Dudics S, Acharya B, Moudgil KD. Cytokine-modulating strategies and newer cytokine targets for arthritis therapy. Int J Mol Sci. 2015;16(1):887-906.
- 14. Migliore A, Ballanti E, Laganà B et al. Biologic agents for rheumatoid arthritis: can we hypothesize new strategies of treatment? Med Hypotheses. 2014;82(1):117-21.
- 15. Martin-Martin LS, Giovannangeli F, Bizzi E et al. An open randomized active-controlled clinical trial with low-dose SKA cytokines versus DMARDs evaluating low disease activity maintenance in patients with rheumatoid arthritis. Drug Design, Development and Therapy. 2017;11:985-94.
- 16. Markusse IM, Dirven L, Gerards AH et al. Disease flares in rheumatoid arthritis are associated with joint damage progression and disability: 10-year results from the BeSt study. Arthritis Res Ther. 2015;17:232. https://doi.org/10.1186/s13075-015-0730-2
- 17. Russell LB, Gold MR, Siegel JE et al. The role of cost-effectiveness analysis in health and medicine. JAMA. 1996;276:1172-7.
- 18. Aletaha D, Neogi T, Silman AJ et al. 2010 rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann Rheum Dis. 2010;69(9):1580-8.
- 19. Adalimumab. Riassunto delle Caratteristiche del Prodotto. Accesso: Aprile 2020. https://www.ema.europa.eu/en/documents/product-information/humira-epar-product-information_it.pdf
- 20. Etanercept. Riassunto delle Caratteristiche del prodotto. Accesso: Aprile 2020. https://www.ema.europa.eu/en/documents/product-information/enbrel-epar-product-information_it.pdf
- 21. Infliximab. Riassunto delle Caratteristiche del Prodotto. Accesso: Aprile 2020. https://www.ema.europa.eu/en/documents/product-information/remicade-epar-product-information_it.pdf
- 22. Certolizumab. Riassunto delle Caratteristiche del Prodotto. Accesso: Aprile 2020. https://www.ema.europa.eu/en/documents/product-information/cimzia-epar-product-information_it.pdf
- 23. Golimumab. Riassunto delle Caratteristiche del Prodotto. Accesso: Aprile 2020. https://www.ema.europa.eu/en/documents/product-information/simponi-epar-product-information_it.pdf
- 24. Lista di trasparenza. Accesso: Aprile 2020. https://www.aifa.gov.it/pt/liste-di-trasparenza
- 25. Abatacept. Riassunto delle Caratteristiche del Prodotto. Accesso: Aprile 2020. https://www.ema.europa.eu/en/documents/product-information/orencia-epar-product-information_it.pdf
- 26. Tocilizumab. Riassunto delle Caratteristiche del Prodotto. Accesso: Aprile 2020. https://www.ema.europa.eu/en/documents/product-information/roactemra-epar-product-information_it.pdf