 |
AboutOpen | 2020; 7(1): 16–20 ISSN 2465-2628 | DOI: 10.33393/abtpn.2020.2141 ORIGINAL RESEARCH ARTICLE |
 |
Analisi di minimizzazione dei costi di MD-Knee rispetto all’acido ialuronico nel trattamento di pazienti con osteoartrosi del ginocchio
A cost-minimization analysis of MD-Knee versus hyaluronic acid in patients with knee osteoarthritis
Introduction: The administration by injection of hyaluronic acid (HA) for 3-5 weeks is effective in the treatment of patients with knee osteoarthritis (OA). Other products for intra-articular use have been recently introduced for the treatment of OA. Among these, a medical device, MD-Knee, produced by Guna S.p.A.; this study aims to estimate the cost-minimization of MD-Knee versus HA in the treatment of knee osteoarthritis.
Methods and Results: We performed a cost-minimization analysis (CMA). The CMA was conducted from the perspective of the Italian National Health Service (iNHS). Only direct medical costs (MD-Knee and HA) were considered. We performed a sensitivity analysis to test the robustness of the results. The mean 6-months cost per patient was € 75,00 with MD-Knee and € 185,00 with HA.
Conclusion: From the Italian National Health Service’s perspective, MD-Knee appears to be the cost-saving therapeutic option compared with HA in the treatment of patients with knee osteoarthritis.
Keywords: Cost, Hyaluronic acid, Italian NHS, MD-Knee, SUPARTZ
Received: May 5, 2020
Accepted: May 20, 2020
Published online: June 12, 2020
© 2020 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0). Any commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu.
Introduzione
L’osteoartrosi (OA) è una malattia degenerativa cronica articolare caratterizzata da un danno progressivo della cartilagine articolare e dell’osso sottostante (1). Rappresenta una delle malattie croniche più comuni, con una prevalenza dell’11% e del 24% nella popolazione adulta per l’OA dell’anca e del ginocchio, rispettivamente (1). Nel 2017 si stima che circa 303 milioni di persone siano stati colpiti da OA in tutto il mondo (2). L’OA, di maggiore prevalenza nella popolazione anziana, è la causa più comune di disabilità, inclusi la limitazione delle attività quotidiane e, soprattutto, il dolore (1). Quest’ultimo è accentuato dai movimenti e diminuisce con il riposo, ma, con il progredire della malattia, può presentarsi anche a riposo. Il burden of disease associato alle malattie muscoloscheletriche è in continuo aumento, diventando, nel 2015, la seconda causa di disabilità (years lived with disability, YLDs) (3).
Diversi studi hanno, inoltre, indagato l’esistenza di una possibile relazione tra OA del ginocchio e mortalità prematura, individuando nella presenza della malattia muscoloscheletrica un indicatore di risultato sfavorevole a causa delle limitazioni che essa induce sulle attività quotidiane e sulla funzionalità fisica dei soggetti colpiti (4-8).
Il termine “grave” è stato definito dalla FDA in presenza di una malattia o di una condizione associate a una morbilità che determina un significativo impatto negativo sulla vita quotidiana di un individuo (9). L’OA presenta tutte le caratteristiche di una condizione grave. Essa limita lo svolgimento delle principali attività quotidiane di una persona (camminare, mangiare, comunicare o prendersi cura di se stessi o di altri familiari), causa un invecchiamento precoce delle persone a causa della perdita di funzionalità all’interno della società e determina un aumento del rischio di mortalità rispetto alla popolazione generale (9).
Dal momento che l’aspettativa di vita della popolazione generale è in continuo aumento, ci si aspetta in crescita anche il numero di persone con OA.
Con la finalità di ridurre il dolore e di raggiungere una condizione clinica ottimale per la gestione dell’OA, le Linee Guida internazionali raccomandano l’uso di una strategia terapeutica che include: 1) trattamento non farmacologico (fisioterapia e riabilitazione), 2) trattamento farmacologico (anti infiammatori non steroidei, analgesici, agenti condroprotettori e trattamenti intra-articolari) e 3) trattamento chirurgico (stadio avanzato della malattia) (10-15).
Nell’ultimo decennio, molta enfasi è stata posta sulla gestione non farmacologica (1). Tuttavia, forse perché le raccomandazioni ad essa associate non sono state sufficientemente chiare in merito a tempistiche, intensità, frequenza, durata e modalità di effettuazione, secondo diversi studi la gestione non farmacologica dell’OA non ha sempre fornito un risultato assistenziale ottimale (16,17).
Anche se le evidenze scientifiche ne suggeriscono una bassa efficacia, il paracetamolo viene ampiamente raccomandato nel trattamento analgesico delle prime fasi dell’OA. Però, dal momento che, nella popolazione generale (specialmente a fronte di elevati dosaggi), è associato alla presenza di eventi avversi gastrointestinali, cardiovascolari, epatici e renali, sarebbe necessaria un’attenta valutazione del suo impiego (18).
Tra le opzioni farmacologiche, l’acido ialuronico, somministrato per via infiltrativa, riveste un ruolo di primaria importanza poiché consente il controllo del dolore e il miglioramento della mobilità articolare, soprattutto nel ginocchio (19). Studi clinici controllati in doppio cieco ne hanno dimostrato la superiorità in termini di efficacia rispetto a soluzione salina, artrocentesi e trattamenti con FANS, oltre a un eccellente profilo di tollerabilità (20,21). Il meccanismo d’azione dell’acido ialuronico è ben conosciuto e, oltre a garantire le proprietà viscoelastiche del liquido sinoviale, svolge un importante ruolo nel mantenere le caratteristiche strutturali e funzionali della cartilagine articolare (20,21). La viscosupplementazione è l’intervento che prevede l’infiltrazione intra-articolare di acido ialuronico. Tra gli acidi ialuronici attualmente disponibili, SUPARTZ® è quello più analizzato negli studi clinici e più utilizzato nella pratica (22).
Dal 2010, il trattamento delle patologie dolorose e degenerative dell’apparato locomotore e di sostegno si avvale di un innovativo approccio terapeutico che prevede l’utilizzo di Medical Device (MD) iniettabili a base di collagene suino. Tra questi è attualmente presente sul mercato MD-Knee (Guna S.p.A.), un dispositivo medico disponibile in flaconcini di soluzione iniettabile a base di collagene di origine suina. La scelta di utilizzare collagene di suino è dettata, oltre che dalla somiglianza biochimica, dal fatto che i tessuti di suino hanno mediamente un contenuto di collagene molto elevato (19). Lo scopo dell’introduzione in loco del collagene è strutturale, poiché il supporto meccanico fornito dal collagene rappresenta un’efficace impalcatura naturale di sostegno (bio-scaffold). Il collagene, infatti, rimpiazza, rinforza e protegge cartilagini, tendini, legamenti e capsule articolari (23-26).
Obiettivo
Lo scopo della presente valutazione economica è confrontare, nella prospettiva ospedaliera, il beneficio e il costo di trattamento associati a MD-Knee e SUPARTZ® nel trattamento dell’OA del ginocchio.
Materiali e metodi
Premessa
La prima fase della presente valutazione economica è stata caratterizzata dalla conduzione di una revisione della letteratura, effettuata tramite la consultazione della banca dati PubMed, per verificare la presenza di studi clinici che avessero confrontato direttamente (head-to-head) le due opzioni di trattamento farmacologico. Un solo studio clinico ha soddisfatto tale requisito (22), le cui principali caratteristiche vengono riassunte nel paragrafo “dati clinici”.
Dati clinici
Lo studio clinico (randomizzato, doppio cieco, prospettico e multicentrico), condotto in Italia da Martin et al. (22), ha valutato la non inferiorità di MD-Knee rispetto all’acido ialuronico (SUPARTZ®) nel trattamento dei pazienti con OA del ginocchio.
L’arruolamento dello studio è iniziato a marzo 2013 e si è concluso a settembre 2013. Sono stati considerati solo i pazienti con OA sintomatica del ginocchio (si rimanda alla pubblicazione per gli specifici criteri di inclusione e di esclusione). Complessivamente, sono stati arruolati 64 pazienti, di cui 32 in trattamento con MD-Knee e 32 con SUPARTZ®. Per ciascun paziente, lo studio ha previsto un totale di 3 visite, una all’arruolamento e una a 3 e a 6 mesi dall’arruolamento. Lo schema posologico adottato per le due opzioni prevedeva, per MD-Knee, la somministrazione, con iniezione intra-articolare, di 4 mL di collagene (due flaconcini da 2 mL) una volta a settimana per 5 settimane consecutive e, per SUPARTZ®, sempre con iniezione intra-articolare, la somministrazione di 2,5 mL di acido ialuronico una volta a settimana per 5 settimane consecutive. L’endpoint primario dello studio è stato il Lequesne Knee Index (LKI), mentre la Visual Analogue Scale (VAS) e il questionario SF-36 sono stati gli endpoint secondari (27). Il LKI ha valutato la gravità dell’OA del ginocchio, mentre VAS e questionario SF-36 hanno valutato, rispettivamente, variazioni di dolore e stato fisico-mentale dei pazienti trattati.
Le principali caratteristiche demografiche dei due gruppi di trattamento sono risultate ben bilanciate all’arruolamento e descritte nella Tabella I. Al follow up a 3 e a 6 mesi, i valori associati a LKI e VAS hanno evidenziato un significativo miglioramento in entrambi i gruppi rispetto all’arruolamento, senza osservare differenze statisticamente significative. Non c’è stata, inoltre, alcuna differenza statisticamente significativa nel punteggio del questionario SF-36. I risultati mostrano che entrambe le opzioni farmacologiche sono risultate ugualmente efficaci nel ridurre i sintomi dell’OA del ginocchio a 6 mesi dall’inizio del trattamento.
| Parametri | MD-Knee | SUPARTZ® |
|---|---|---|
| (n. = 32) | (n. = 32) | |
| Età (anni ± DS) | 69,41 ± 8,42 | 69,97 ± 9,5 |
| Femmine, n. (%) | 25 (86,2%) | 20 (64,5%) |
| BMI (Kg/m2) | 27,2 ± 3,78 | 27,3 ± 3,56 |
| Kellgren e Lawrence grado II, n. (%) | 15 (51%) | 17 (55%) |
| Kellgren e Lawrence grado III, n. (%) | 14 (44%) | 14 (44%) |
| LKI ± DS | 12,45 ± 2,63 | 12,6 ± 3,48 |
| SF-36 ± DS | 91,41 ± 20,01 | 93,07 ± 17,3 |
| VAS ± DS | 7,67 ± 1,41 | 7,42 ± 1,35 |
Tecnica di valutazione
Dato che lo studio clinico (22) non ha evidenziato differenze di efficacia, si è ritenuto corretto confrontare MD-Knee e SUPARTZ® tramite un’analisi di minimizzazione dei costi (cost-minimization analysis, CMA), ponendo, così, l’accento sui soli costi farmacologici.
Orizzonte temporale
In accordo con il periodo di osservazione dello studio clinico di riferimento (22), è stato adottato un orizzonte temporale di analisi pari a 6 mesi, ovvero di 26 settimane.
Prospettiva di analisi
Dal momento che i due farmaci non sono attualmente rimborsati dal Sistema Sanitario Nazionale (SSN) e che tendenzialmente le relative somministrazioni vengono effettuate in ambito ospedaliero (ambulatorio o day hospital), la prospettiva di analisi qui adottata è quella dell’ospedale, nell’ipotesi che la stessa struttura si faccia carico dell’acquisto.
Consumo di risorse e costi unitari
Il consumo dei due regimi terapeutici è stato valorizzato moltiplicando i dosaggi indicati nello studio clinico (22) per i relativi prezzi di mercato (prezzo al pubblico). Sono stati considerati un prezzo al pubblico di € 75,00 per una confezione da 10 flaconcini da 2 mL di MD-Knee e un prezzo al pubblico di € 185,00 per una confezione da 5 pezzi da 2,5 mL di SUPARTZ®. Coerentemente con l’obiettivo dello studio (stimare i costi incrementali tra le due terapie) e con la tecnica di valutazione economica adottata (CMA), non è stato considerato alcun costo associato alla somministrazione, in quanto assunto uguale in entrambi casi (una somministrazione settimanale per 5 settimane consecutive). Dal momento che lo studio clinico di riferimento (22) non ha identificato differenze significative in termini di tollerabilità, non sono stati considerati costi per la gestione di eventuali eventi avversi correlati al trattamento somministrato.
Analisi di sensibilità
Come indicato dalle Linee Guida redatte dal gruppo AIES (Associazione Italiana di Economia Sanitaria) (28), l’analisi di sensibilità dovrebbe analizzare in modo approfondito l’incertezza del risultato del caso base (o caso di riferimento, CDR). In questa valutazione, l’analisi dell’incertezza è stata effettuata esclusivamente in riferimento ai prezzi di acquisto delle due opzioni farmacologiche. A questo proposito, per stimare l’incertezza relativa a tale variabile, è state condotta un’analisi della soglia (threshold analysis), con l’obiettivo di stimare per quali riduzioni del prezzo di acquisto le due opzioni risulterebbero costo-neutrali.
Risultati
Analisi di minimizzazione dei costi
La Tabella II riporta i risultati della CMA descrivendo il costo medio di trattamento per le due alternative terapeutiche.
| Parametri | A | B |
|---|---|---|
| MD-Knee | SUPARTZ® | |
| Dose per somministrazione | 4 mL | 2,5 mL |
| Costo per somministrazione | € 15,00 | € 37,00 |
| N. somministrazioni totali | 5 | 5 |
| Costo medio di trattamento | € 75,00 | € 185,00 |
| Differenza (A-B) | -€ 110,00 | |
Appare evidente come, a fronte di un minor costo per singola somministrazione (€ 15,00 vs € 37,00), il paziente trattato con MD-Knee sia caratterizzato dal minor costo medio di trattamento (€ 75,00 vs € 185,00), determinando un risparmio di € 110,00 per l’intero ciclo di trattamento.
Analisi di sensibilità
L’analisi della soglia condotta per stimare l’incertezza associata al prezzo al pubblico mostra come, mantenendo costante il prezzo di MD-Knee (caso base), solo a fronte di una sensibile riduzione del prezzo di SUPARTZ® (-59,5%) le due alternative terapeutiche sarebbero costo-neutrali, ovvero determinerebbero lo stesso costo medio per paziente trattato (Fig. 1).
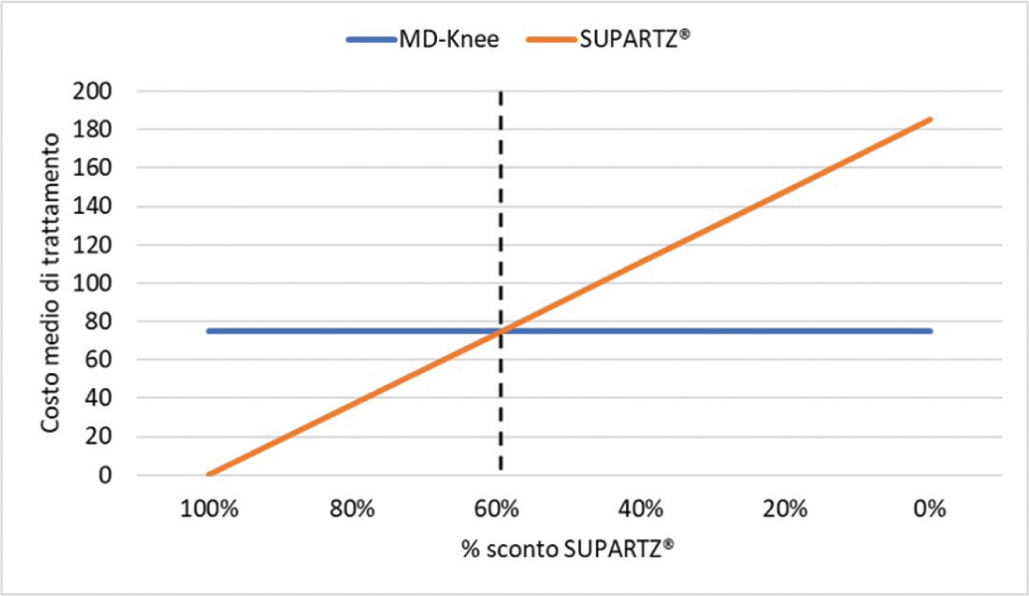
Fig. 1 - Analisi della soglia.
Discussione
L’OA è una condizione clinica che caratterizza gran parte della popolazione, soprattutto anziana. Il costante e continuo invecchiamento della popolazione, in virtù di una crescita dell’aspettativa di vita, lascia facilmente ipotizzare che, nel prossimo futuro, sarà sempre maggiore il numero di soggetti affetti da questa patologia, di cui circa un quarto con osteoartrosi del ginocchio.
Come evidenziato da alcuni studi pubblicati in letteratura, l’adozione di una strategia non farmacologica non sempre si è rivelata una misura efficace nell’affrontare l’OA (16,17). Per questo motivo, l’identificazione di un’opzione farmacologica in grado di garantire un’adeguata risposta clinica e, al contempo, di ritardare o prevenire l’intervento chirurgico diventa fondamentale nell’affrontare l’OA. Tra i trattamenti farmacologici, la somministrazione dell’acido ialuronico ha dimostrato un’efficacia superiore rispetto all’uso di anti-infiammatori non steroidei o di analgesici (20,21). Il successivo arrivo sul mercato di Medical Device iniettabili a base di collagene suino ha rappresentato un’opzione di equivalente efficacia nella gestione dell’OA del ginocchio, come anche indicato dallo studio di confronto diretto condotto in Italia da Martin et al. (22).
A parità di efficacia (22), un successivo driver di scelta terapeutica potrebbe essere rappresentato dal costo di trattamento, soprattutto se considerato all’interno di un più ampio discorso di sostenibilità della spesa sanitaria.
Alla luce di quanto riportato sopra, si è scelto, in questa sede, di condurre un’analisi di minimizzazione dei costi finalizzata a confrontare, lungo un orizzonte di sei mesi, il costo associato a MD-Knee, un Medical Device iniettabile a base di collagene suino, rispetto a SUPARTZ®, una soluzione a base di acido ialuronico. Dal momento che entrambi i farmaci non vengono rimborsati dal SSN, come prospettiva di analisi è stata adottata quella dell’ospedale, nell’ipotesi che la stessa struttura si faccia carico dell’acquisto dei farmaci. Il risultato dell’analisi di minimizzazione ha evidenziato per MD-Knee (€ 75,00) un minor costo medio di trattamento, pari a € 110,00, rispetto a SUPARTZ® (€ 185,00). Dal momento che sono stati considerati i relativi prezzi al pubblico, per tenere conto di eventuali scontistiche concesse alle strutture ospedaliere in caso di acquisto di grossi quantitativi di farmaco, è stata condotta un’analisi della soglia, per verificare a quale riduzione del prezzo di SUPARTZ®, mantenendo costante quello di MD-Knee, le due alternative risulterebbero costo-neutrali. Allo stato attuale, sarebbe necessaria una riduzione di quasi il 60% del prezzo di SUPARTZ®, affinché il costo medio di trattamento risultasse uguale per entrambe le alternative. Non è stato fatto in questa sede, ma sarebbe interessante condurre una breve indagine per verificare quale siano, in media, gli effettivi prezzi praticati alle strutture ospedaliere per l’acquisto dei due farmaci.
Il risultato a vantaggio di MD-Knee, espresso in termini di minor costo medio di trattamento, potrebbe essere esteso anche se l’analisi fosse stata condotta considerando la prospettiva del paziente e, quindi, ipotizzando che non fosse l’ospedale a farsi carico dell’acquisto del farmaco, ma il paziente stesso. In questo caso potremmo parlare di un minore impatto sul costo sociale dell’OA del ginocchio.
La presente analisi deve essere letta alla luce di alcune osservazioni, prima fra tutte quella di avere realizzato il confronto lungo un orizzonte temporale di soli sei mesi, rispetto, probabilmente, a un follow-up maggiore richiesto dalla gestione dell’OA del ginocchio. Il confronto economico riflette, di fatto, l’arco temporale di osservazione adottato dallo studio clinico di riferimento (22) e si è, quindi, ritenuto più corretto non estrapolare da un orizzonte temporale più ampio i risultati dello stesso. Una seconda osservazione riguarda il fatto che, nella valutazione economica tra gli acidi ialuronici disponibili, sia stato considerato il solo SUPARTZ®. Tale scelta è avvenuta per due motivazioni: la prima è che SUPARTZ® è ampiamente utilizzato nella pratica clinica e si è dimostrato efficace in precedenti studi e la seconda è che, in letteratura, non sono presenti confronti diretti di MD-Knee rispetto ad altri tipi di acido ialuronico (p. es., reticolato, alto peso molecolare), non consentendo, quindi, di fatto, di trarre conclusioni definitive sull’efficacia del dispositivo medico MD-Knee rispetto a questi ultimi.
Conclusioni
Sulla base dei risultati qui trovati, si ritiene che, per quanto riguarda la gestione dell’osteoartrosi del ginocchio, MD-Knee rappresenti, per l’ospedale (o per il paziente), un’opzione più efficiente rispetto a un acido ialuronico di medio peso molecolare come SUPARTZ®, in quanto, a parità di tossicità e di efficacia, determina un minore costo medio di trattamento lungo un orizzonte temporale di 6 mesi.
Disclosures
Financial support: This research was made possible by an educational grant from Guna S.p.A.
Conflict of interest: None of the authors has financial interest related to this study to disclose.
Bibliografia
- 1. Linda Fernandes, Kåre B Hagen, Johannes W J Bijlsma, et al. EULAR recommendations for the non-pharmacological core management of hip and knee osteoarthritis. Ann Rheum Dis. 2013;72:1125-35.
- 2. Kloppenburg M, Berenbaum F. Osteoarthritis year in review 2019: epidemiology and therapy. Osteoarthritis Cartilage. 2020;28(3):242-8.
- 3. Sebbag E, Felten R, Sagez F, Sibilia J, Devilliers H, Arnaud L. The world-wide burden of musculoskeletal diseases: a systematic analysis of the World Health Organization Burden of Diseases Database. Ann Rheum Dis. 2019;78(6):844-8.
- 4. Kluzek S, Sanchez-Santos MT, Leyland KM, et al. Painful knee but not hand osteoarthritis is an independent predictor of mortality over 23 years follow-up of a population-based cohort of middle-aged women. Ann Rheum Dis. 2016;75(10):1749-56.
- 5. Cleveland RJ, Alvarez C, Schwartz TA, et al. The impact of painful knee osteoarthritis on mortality: a community-based cohort study with over 24 years of follow-up. Osteoarthritis Cartilage. 2019;27(4):593-602.
- 6. Corsi M, Alvarez C, Callahan LF, et al. Contributions of symptomatic osteoarthritis and physical function to incident cardiovascular disease. BMC Muscoskelet Disord. 2018;19(1):393.
- 7. Turkiewicz A, Kiadaliri AA, Englund M. Cause-specific mortality in osteoarthritis of peripheral joints. Osteoarthritis Cartilage. 2019;27(6):848-54.
- 8. Hawker GA, Croxford R, Bierman AS, et al. All-cause mortality and serious cardiovascular events in people with hip and knee osteoarthritis: a population based cohort study. PLoS One. 2014;9(3):e91286.
- 9. OARSI. Osteoarthritis: A Serious Disease, Submitted to the U.S. Food and Drug Administration. December 1, 2016. https://www.oarsi.org/sites/default/files/library/2018/pdf/oarsi_white_paper_oa_serious_disease121416_1.pdf.
- 10. Conrozier T, Monfort J, Chevalier X, et al. EUROVISCO Recommendations for Optimizing the Clinical Results of Viscosupplementation. Osteoarthritis Cartilage. 2020;11(1):47-59. Epub 2018 Jun 21.
- 11. Raman R, Henrotin Y, Chevalier X, et al. Decision Algorithms for the Retreatment with Viscosupplementation in Patients Suffering from Knee Osteoarthritis: Recommendations from the EUROpean VIScosupplementation COnsensus Group (EUROVISCO). Cartilage. 2018;9(3):263-75.
- 12. Cooper C, Rannou F, Richette P, et al. Use of Intraarticular Hyaluronic Acid in the Management of Knee Osteoarthritis in Clinical Practice. Arthritis Care Res (Hoboken). 2017;69(9):1287-96.
- 13. Paoloni M, Bernetti A, Belelli A, et al. Appropriateness of clinical and organizational criteria for intra-articular injection therapies in osteoarthritis. A Delphi method consensus initiative among experts in Italy. Ann Ist Super Sanita. 2015;51(2):131-8.
- 14. Bruyère O, Honvo G, Veronese N, et al. An updated algorithm recommendation for the management of knee osteoarthritis from the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Semin Arthritis Rheum. 2019;49(3):337-50.
- 15. Trojian TH, Concoff AL, Joy SM, Hatzenbuehler JR, Saulsberry WJ, Coleman CI. AMSSM scientific statement concerning viscosupplementation injections for knee osteoarthritis: importance for individual patient outcomes. Br J Sports Med. 2016;50(2):84-92.
- 16. Broadbent J, Maisey S, Holland R, et al. Recorded quality of primary care for osteoarthritis: an obervational study. Br J Gen Pract. 2008;58:839-43.
- 17. Snijders GF, den Broeder AA, van Riel PLCM, et al. Evidence-based tailored conservative treatment of knee and hip osteoarthritis: between knowing and doing. Scand J Rheumatol. 2011;40:225-31.
- 18. Conaghan PG, Arden N, Avouac B, Migliore A, Rizzoli R. Safety of Paracetamol in Osteoarthritis: What Does the Literature Say? Drugs Aging. 2019;36(Suppl. 1):7-14.
- 19. Ruiu DE. Medical Device iniettabili a base di collagene. Stato dell’arte e overview degli studi clinici. Advanced Therapies. Numero 1. 2012.
- 20. Maheu E, Bannuru RR, Herrero-Beaumont G, Allali F, Bard H, Migliore A. Why we should definitely include intra-articular hyaluronic acid as a therapeutic option in the management of knee osteoarthritis: Results of an extensive critical literature review. Semin Arthritis Rheum. 2019;48(4):563-72.
- 21. Cooper C, Rannou F, Richette P, et al. Use of Intraarticular Hyaluronic Acid in the Management of Knee Osteoarthritis in Clinical Practice. Arthritis Care Res (Hoboken). 2017;69(9):1287-96.
- 22. Martin LSM, Massafra U, Bizzi E, Migliore A. A double blind randomized active controlled clinical trial on the intra-articular use of Md-Knee versus sodium hyaluronate in patients with knee osteoarthritis (“Joint”). BMC Musculoskelet Disord. 2016;17:94.
- 23. Di Cesare ML, Micheli L, Zanardelli M, Ghelardini C. Low dose native type II collagen prevents pain in a rat osteoarthritis model. BMC Musculoskelet Disord. 2013;14:228.
- 24. Naraoka T, Ishibashi Y, Tsuda E, Yamamoto Y, Kusumi T, Toh S. Periodic knee injections of collagen tripeptide delay cartilage degeneration in rabbit experimental osteoarthritis. Arthritis Res Ther. 2013;15(1):R32.
- 25. Xiao D, Hu J, Chen K, Man C, Zhu S. Protection of articular cartilage by intra-articular injection of NEL-like molecule 1 in temporomandibular joint osteoarthritis. J Craniofac Surg. 2012;23(1):e55-8.
- 26. Milani L. Un nuovo e raffinato trattamento iniettivo delle patologie algiche dell’Apparato locomotore. Le proprietà bio-scaffold del collagene e suo utilizzo clinico. La Med Biol. 2010;3:3-15.
- 27. Pham T, van der Heijde D, Altman RD, et al. OMERACT-OARSI initiative: osteoarthritis research society international set of responder criteria for osteoarthritis clinical trials revisited. Osteoarthr Cartil. 2004;12(5):389-99.
- 28. Gruppo di lavoro AIES (coordinato da G. Fattore). Proposta di Linee Guida per la valutazione economica degli interventi sanitari in Italia. PharmacoEconomics-Italian Research Articles. 2009;11:83-93.