 |
AboutOpen | 2020; 7(1): 04–08
ORIGINAL RESEARCH ARTICLE |
 |
Analisi di budget impact del biosimilare di pegfilgrastim nel trattamento della neutropenia febbrile in Italia
Budget impact analysis of pegfilgrastim biosimilar in the treatment of febrile neutropenia in Italy
Introduction: Granulocyte-colony stimulating factors (G-CSFs) can significantly reduce the risk of febrile neutropenia (FN) among certain patients receiving chemotherapy. FN is associated with significant clinical and nonclinical complications. At present, the patent protection of pegfilgrastim (Neulasta®) has expired, and a biosimilar (Ziextenzo®) has been approved. Since the biosimilar price is expected to be lower as compared with the originator’s, the present Drug Budget Impact analysis tries to evaluate whether and how much profitable the biosimilar availability will be for the Italian NHS, in terms of cost containment (savings).
Methods and Results: The model time horizon extends to five years. The initial overall number of treatments with pegfilgrastim is estimated based on the number of pegfilgrastim packages (assuming a recommended dose of 6 mg is administered after each cytotoxic chemotherapy) and kept constant in time. The model assumes that, year by year, the number of treatments with the originator will partly switch to the biosimilar (according to an uptake rate assumed). The results show that the availability of the biosimilar would provide an €6.4 million cumulated savings to the NHS in the five years.
Conclusions: According to the present analysis, the availability of the biosimilar would generate cumulated savings (in five years) as high as €6.4 million for the Italian NHS.
Keywords: Biosimilar, Cost, G-CSF, Italian NHS, Pegfilgrastim
Received: February 12, 2020
Accepted: February 17, 2020
Published online: February 28, 2020
© 2020 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC-ND 4.0). Any commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu
Introduzione
La neutropenia rappresenta un comune evento avverso determinato dalla somministrazione di una chemioterapia mielosoppressiva (citossica) (1). Nei soggetti colpiti da mielosoppressione il midollo osseo non è in grado di sintetizzare una quantità adeguata di cellule ematiche. In ambito oncologico destano particolare attenzione i livelli dei globuli bianchi e dei granulociti neutrofili; questo perché un loro eccessivo calo renderebbe il paziente suscettibile allo sviluppo di una grande varietà di infezioni che spesso determinano il ricovero ospedaliero e il trattamento con antibiotici ad ampio spettro (2, 3, 4). La neutropenia febbrile (NF) è la più rilevante complicanza della neutropenia ed è definita da rialzo termico >38,5°C per una durata superiore a un’ora, oppure da rialzo termico pari a 38°C per tre misurazioni consecutive alla distanza di un’ora dall’altra, in presenza di una conta dei neutrofili <500 µL o <1000 µL con prevedibile declino <500 µL nelle successive 48 ore (5).
Abbastanza frequente nel primo ciclo chemioterapico (4, 6), la NF è quindi associata a un aumento di morbilità e mortalità, con un significativo aumento dei costi di trattamento (4, 7, 8, 9). Oltre l’aumento di morbilità e mortalità, la presenza di NF può compromettere l’ottimale schema di somministrazione della chemioterapia, causando ritardi nella somministrazione o riduzioni dell’intensità della dose della terapia oncologica (4, 10, 11).
Le Linee Guida Statunitensi ed Europee sono concordi nel raccomandare una terapia di profilassi con fattori stimolanti la crescita di granulociti (G-CSF) per i pazienti trattati con chemioterapici citotossici associati ad alto rischio di NF (5, 12 13, 14, 15). I G-CSF promuovono la crescita dei neutrofili per accelerare il recupero dopo la chemioterapia (2, 16). La profilassi con G-CSF può essere presa in considerazione anche nei pazienti con un rischio intermedio di NF, a seconda della presenza di fattori di rischio quali età, stato della malattia, comorbilità e precedente storia di NF (14).
L’uso di G-CSF nei pazienti con tumori solidi o neoplasie non mieloidi ha dimostrato di ridurre il rischio di ospedalizzazione, di morte e di riduzione dell’intensità della dose, migliorando allo stesso tempo la qualità di vita correlata alla chemioterapia somministrata (17, 18).
Poiché la spesa farmaceutica è aumentata considerevolmente negli ultimi decenni, le Agenzie regolatorie sono state costrette a individuare soluzioni alternative per promuovere il contenimento dei costi. L’adozione dei farmaci biosimilari può essere considerata una di queste soluzioni.
In quest’ottica, ovvero in tema di sostenibilità della spesa farmaceutica, la scadenza della protezione brevettuale di pegfilgrastim ha indotto investimenti da parte delle aziende farmaceutiche nella produzione del corrispettivo farmaco “biosimilare”.
L’autorizzazione all’immissione in commercio di un farmaco biosimilare avviene tramite l’esercizio di comparabilità. Questo iter procedurale, disciplinato dalle Guideline on Similar Biological Medicinal Products emanate dall’Agenzia Europea dei Medicinali (European Medicines Agency, EMA) alle quali si rimanda per maggiori approfondimenti, è basato sul confronto diretto tra biosimilare e corrispettivo medicinale originatore espresso in termini di qualità, sicurezza ed efficacia clinica e non clinica (19, 20, 21, 22).
Pegfilgrastim, forma long-acting del farmaco biologico filgrastim, è indicato nel trattamento di riduzione della durata della neutropenia e dell’incidenza di NF in pazienti adulti trattati con chemioterapia citotossica per neoplasie. In Italia, alcuni biosimilari di pegfilgrastim sono disponibili dalla seconda metà del 2019. Poiché per definizione un farmaco biosimilare è comparabile in termini di efficacia e sicurezza con l’originatore, il beneficio associato alla sua immissione in commercio è esclusivamente economico ed è rappresentato dal minor prezzo di rimborso.
Negli ultimi 10 anni l’utilizzo dei farmaci biosimilari ha rivestito sempre più un ruolo fondamentale per la sostenibilità dell’innovazione farmaceutica (23). Con riferimento al mercato dei 5 principali Paesi europei (Gran Bretagna, Francia, Italia, Germania, Spagna), l’Italia si colloca in una posizione medio-alta nella classifica relativa alla penetrazione dei biosimilari (23). Ad esempio, con riferimento a infliximab, lanciato nel 2015, l’Italia ha raggiunto nel 2017 una penetrazione del 61%, seconda sola alla Gran Bretagna (88%) (23).
Obiettivo
La presente analisi, considerando la prospettiva del Servizio Sanitario Nazionale (SSN), ha stimato l’impatto sulla spesa farmaceutica che potrebbe derivare dai potenziali risparmi generati in Italia nei prossimi anni dall’utilizzo del biosimilare di pegfilgrastim rispetto all’originatore.
Materiali e metodi
Con la finalità di stimare l’impatto finanziario generato dall’utilizzo del biosimilare di pegfilgrastim (Ziextenzo®) è stato realizzato uno specifico modello di Drug Budget Impact (DBI) in Excel®, nel quale è stato ipotizzato che il biosimilare possa, nei cinque anni di osservazione, in parte sostituirsi all’originatore (Neulasta®). Grazie a un minore costo rispetto all’originatore, il biosimilare determinerebbe dei risparmi (riduzione della spesa farmaceutica) a vantaggio del SSN, misurabili confrontando la relativa spesa farmaceutica nella duplice ipotesi (scenario) di non crescita o crescita delle quote di utilizzo del biosimilare. In entrambi le ipotesi, nel primo anno di osservazione (che coincide con il primo anno di commercializzazione del biosimilare), la spesa riferita all’attuale situazione di mercato è costituita dal costo farmacologico dei pazienti trattati con l’originatore in aggiunta a quello dei restanti pazienti in trattamento col biosimilare. Nei successivi quattro anni di osservazione, nello scenario di non crescita del biosimilare le quote di mercato (biosimilare e originatore) rimangono costanti, mentre in quello di crescita le quote di mercato dell’originatore diminuiscono a favore del biosimilare.
La spesa farmaceutica qui analizzata è stata costruita partendo dal numero di confezioni di pegfilgrastim (1 siringa da 6 mg soluzione iniettabile) di originatore e biosimilare utilizzate in riferimento all’attuale mercato (24). Successivamente, sulla base delle indicazioni terapeutiche riportate nel Riassunto delle Caratteristiche del Prodotto (RCP) di pegfilgrastim, ovvero di una dose raccomandata di 6 mg (corrispondente a una siringa) somministrata almeno 24 ore dopo ciascun ciclo di chemioterapia citotossica, è stato desunto (con un rapporto di una somministrazione ogni ciclo di chemioterapia citotossica) il corrispondente numero di cicli di chemioterapie citotossiche trattate con pegfilgrastim, che nel primo anno di osservazione ammontano a 39.388. Di queste, basandosi sempre sui dati di mercato, circa il 94% (36.907) sono trattate con l’originatore, mentre solo il restante 6% circa (2.481) con il biosimilare. La stima del numero complessivo dei cicli di chemioterapie citotossiche viene mantenuta costante nei quattro anni successivi.
Il dettaglio dei tassi di uptake (e il relativo numero di cicli di chemioterapie citotossiche trattate con pegfilgrastim biosimilare o originatore), adottati dal DBI del biosimilare rispetto all’originatore nei cinque anni di osservazione, riflette la stima di un panel di esperti effettuata sulla base dei dati di mercato attualmente disponibili (Tab. I). Il tasso di sostituzione del biosimilare parte da un 6,3% nel primo anno fino ad arrivare a un 25% nel quinto anno di osservazione (tasso medio annuo di crescita del 41,1%) (Tab. I).
Il costo medio di trattamento per paziente/anno sia dell’originatore sia del biosimilare di pegfilgrastim riflette il prezzo ex-factory al netto degli sconti obbligatori di legge. Specificamente, il costo di 1 siringa preriempita da 6 mg di pegfilgrastim originatore è pari a €902,51 mentre quello del biosimilare è pari a €541,50 (differenza pari a €361,01).
Data la sovrapponibilità terapeutica tra biosimilare e originatore, il DBI non considera eventuali costi di trattamento associati a eventi evitati e/o effetti collaterali.
La Figura 1 illustra schematicamente la struttura del DBI. L’analisi è stata condotta osservando quanto indicato dalle Linee Guida dell’International Society for Pharmacoeconomics and Outcomes Research (ISPOR) per la conduzione di una Budget Impact Analysis (BIA) (25, 26).
Risultati
Sulla base dei dati mercato (consumi di pegfilgrastim) e dei tassi di uptake del biosimilare rispetto all’originatore, il numero dei cicli delle chemioterapie citotossiche trattate con il biosimilare aumenterebbe da 2.481 nel primo anno di osservazione a 9.847 nel quinto anno di osservazione, mentre per il farmaco originatore il numero dei trattamenti si ridurrebbe da 36.907 nel primo anno a 29.541 nel quinto anno (Tab. II).
| I anno | II anno | III anno | IV anno | V anno | |
|---|---|---|---|---|---|
| Scenario a quote di mercato costanti | |||||
| Pegfilgrastim originatore | 93,7% | 93,7% | 93,7% | 93,7% | 93,7% |
| Pegfilgrastim biosimilare | 6,3% | 6,3% | 6,3% | 6,3% | 6,3% |
| Scenario a quote di mercato variabili | |||||
| Pegfilgrastim originatore | 93,7% | 90% | 85% | 80% | 75% |
| Pegfilgrastim biosimilare | 6,3% | 10% | 15% | 20% | 25% |
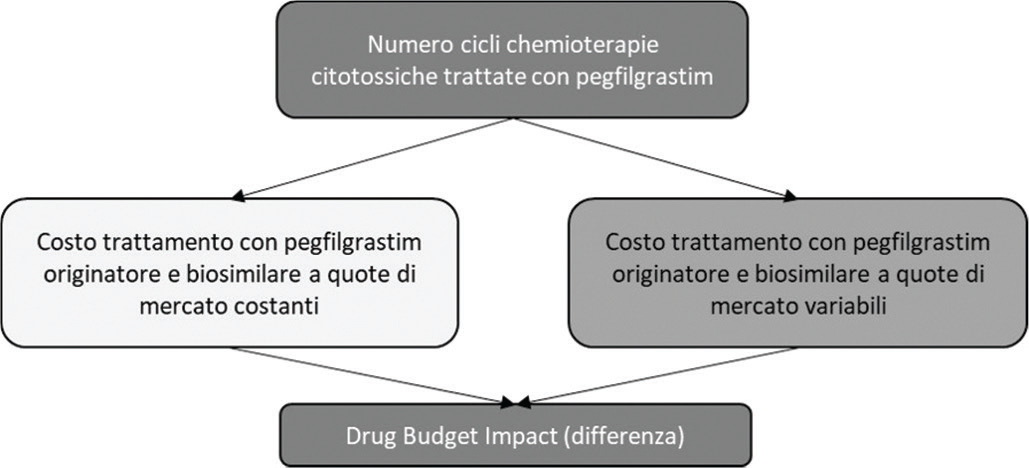
Fatta eccezione per il primo anno, in cui è stata ipotizzata per entrambi gli scenari la stessa distribuzione tra trattamenti con biosimilare e originatore, a partire dal secondo anno di osservazione, in virtù di un minore prezzo, l’aumento del numero di trattamenti effettuati con il biosimilare determinerebbe una sensibile riduzione della spesa farmaceutica a carico del SSN (Tab. II). Nel secondo anno a fronte di un maggiore numero di cicli di chemioterapie citotossiche trattate con il biosimilare (+1.458 trattamenti) si determinerebbe una riduzione di spesa pari a €526.000 (Tab. II). Nel corso dei successivi anni il risparmio per il SSN dovuto al graduale aumento di utilizzo del biosimilare salirebbe da €1.237.253 del terzo anno ai 2.659.200 del quinto anno, con un risparmio cumulato nel quinquennio di €6.370.960 (Tab. II).
Discussione
La presente analisi di Drug Budget Impact è stata effettuata con l’obiettivo di stimare l’impatto finanziario per il SSN conseguente all’aumento dell’utilizzo del biosimilare di pegfilgrastim indicato nel trattamento di riduzione della durata della neutropenia e dell’incidenza di NF in pazienti adulti trattati con chemioterapia citotossica per neoplasie.
La stima del numero di trattamenti (cicli di chemioterapie citotossiche), i tassi annui di uptake del biosimilare rispetto all’originatore di pegfilgrastim e il minore prezzo del biosimilare mostrano nel quinquennio un risparmio cumulato a vantaggio del SSN di circa 6,3 milioni di euro; tale risparmio passa dall’1,5% (€526.280) del secondo anno all’8,3% (€2.659.200) del quinto anno.
Purtroppo, non è possibile confrontare direttamente questi risultati con quelli di altre analisi condotte in ambito nazionale se non indirettamente, ovvero in termini di potenziale espansione del mercato biosimilare e dei risparmi associati. Un recente rapporto redatto dal centro studi IQVIA sui farmaci biologici e biosimilari conclude infatti affermando che l’ingresso dei biosimilari ha generato nel mercato un effetto competitivo, determinando una riduzione dei prezzi dei biologici che hanno perso la protezione brevettuale e una conseguente maggiore sostenibilità del trattamento correlato (23). L’arrivo dei biosimilari e l’effetto competitivo rispetto ai farmaci biologici hanno permesso, almeno in alcune aree terapeutiche, di garantire un risparmio per i Sistemi sanitari (23). L’analisi condotta da Marcellusi et al., lungo un orizzonte temporale di sei anni, ha stimato l’impatto finanziario aggregato dei biosimilari di infliximab ed etanercept nel trattamento dell’artrite reumatoide, della psoriasi, delle malattie infiammatorie intestinali e dell’artrite psoriasica (27). Grazie all’introduzione sul mercato di questi farmaci biologici si potrebbero risparmiare dai 132 ai 296 milioni di euro.
A livello internazionale lo studio di McBride et al. ha valutato invece la costo-efficienza determinata dall’utilizzo di filgrastim biosimilare rispetto a filgrastim e pegfilgrastim originatori (28). Gli Autori non presentano l’impatto finanziario dell’utilizzo del biosimilare nel mercato americano, ma concludono affermando che a filgrastim biosimilare, rispetto agli originatori, è associata una significativa riduzione dei costi di trattamento (28). Sun et al. offrono invece un ulteriore spunto di riflessione derivante dall’utilizzo del biosimilare di filgrastim (29). Aumentare l’uso di un G-CSF biosimilare per gestire la NF indotta dalla chemioterapia determinerebbe significativi risparmi sui costi di trattamento tali da essere riallocati per garantire l’accesso al trattamento antineoplastico a un maggior numero di pazienti (29). Semplicemente, il passaggio a un G-CSF biosimilare costituirebbe un vantaggio perché un numero maggiore di pazienti potrebbe essere trattato con una terapia mirata e ricevere, allo stesso tempo, una terapia di supporto con G-CSF (29). Ciò determinerebbe un vantaggio per il sistema salute, offrendo una soluzione neutra dal punto di vista economico in virtù di un miglioramento dell’accesso dei pazienti alle cure antitumorali primarie e di una maggiore sostenibilità del relativo onere economico (29).
Nel presente Drug Budget Impact, poiché costruito con lo scopo di stimare l’impatto economico sulla spesa farmaceutica pubblica derivante dall’utilizzo del biosimilare rispetto all’originatore di pegfilgrastim, sono state semplificate alcune variabili di contesto di seguito brevemente richiamate. I tassi di uptake del biosimilare e le quote di mercato dell’originatore, seppur stimate da un panel di esperti e riscontrate con i dati di mercato, non hanno tenuto conto, per assunzione, dell’eventuale presenza di specifiche politiche regionali/locali quali determinanti del mercato o della spesa farmaceutica. Ne consegue che se la presente analisi fosse condotta in Regioni caratterizzate da politiche volte a favorire l’ingresso e l’utilizzo del biosimilare, il risparmio sarebbe risultato maggiore. Nonostante non sia possibile accogliere nel modello di simulazione tutte le sfaccettature di eventuali politiche regionali/locali, le stime delle quote di mercato di pegfilgrastim e dei tassi di uptake del biosimilare hanno comunque cercato di riprodurre i comportamenti prescrittivi adottabili nella pratica clinica.
| I anno | II anno | III anno | IV anno | V anno | |
|---|---|---|---|---|---|
| Scenario a quote di mercato costanti | |||||
| Numero cicli trattati con pegfilgrastim | 39.388 | 39.388 | 39.388 | 39.388 | 39.388 |
| Cicli trattati con pegfilgrastim originatore | 36.907 | 36.907 | 36.907 | 36.907 | 36.907 |
| Cicli trattati con pegfilgrastim biosimilare | 2.481 | 2.481 | 2.481 | 2.481 | 2.481 |
| Spesa trattamento con pegfilgrastim | 34.652.398 | 34.652.398 | 34.652.398 | 34.652.398 | 34.652.398 |
| Spesa trattamento con pegfilgrastim originatore | € 33.308.937 | € 33.308.937 | € 33.308.937 | € 33.308.937 | € 33.308.937 |
| Spesa trattamento con pegfilgrastim biosimilare | € 1.343.462 | € 1.343.462 | € 1.343.462 | € 1.343.462 | € 1.343.462 |
| Scenario a quote di mercato variabili | |||||
| Numero cicli trattati con pegfilgrastim | 39.388 | 39.388 | 39.388 | 39.388 | 39.388 |
| Cicli trattati con pegfilgrastim originatore | 36.907 | 35.449 | 33.480 | 31.510 | 29.541 |
| Cicli trattati con pegfilgrastim biosimilare | 2.481 | 3.939 | 5.908 | 7.878 | 9.847 |
| Spesa trattamento con pegfilgrastim | 34.652.398 | 34.126.118 | 33.415.145 | 32.704.172 | 31.993.198 |
| Spesa trattamento con pegfilgrastim originatore | € 33.308.937 | € 31.993.257 | € 30.215.854 | € 28.438.451 | € 26.661.048 |
| Spesa trattamento con pegfilgrastim biosimilare | € 1.343.462 | € 2.132.860 | € 3.199.290 | € 4.265.720 | € 5.332.151 |
| Risparmio annuo | € 0 | € 526.280 | € 1.237.253 | € 1.948.227 | € 2.659.200 |
| Risparmio cumulato | € 0 | € 526.280 | € 1.763.534 | € 3.711.760 | € 6.370.960 |
Il Drug Budget Impact, infine, non ha considerato l’effetto sul prezzo di pegfilgrastim biosimilare e originatore che eventuali gare regionali/locali potrebbero esercitare, o l’effetto competitivo che il prezzo del biosimilare di pegfilgrastim potrebbe esercitare sulle politiche di prezzo adottabili dall’azienda titolare dell’immissione in commercio dell’originatore di pegfilgrastim. Questa scelta è stata presa con l’obiettivo di presentare una panoramica nazionale e generale dell’impatto finanziario del biosimilare di pegfilgrastim, prescindendo dalla presenza di differenti politiche di prezzo adottate in ambito regionale o di differenti strategie di prezzo adottate in ambito aziendale, entrambi attualmente poco prevedibili.
Conclusioni
Complessivamente, seppur con i limiti associati all’utilizzo di un modello di simulazione, la presente analisi di Drug Budget Impact ha presentato uno scenario caratterizzato da apprezzabili risultati positivi, in termini di risparmio della spesa farmaceutica a carico del SSN, quale conseguenza di un maggior utilizzo del biosimilare di pegfilgrastim. Più in generale, come emerso anche da altre analisi condotte in riferimento al contesto nazionale, è verosimile ipotizzare che nel prossimo futuro i farmaci biosimilari determineranno un sempre maggior contributo alla sostenibilità della spesa farmaceutica pubblica. Per questo motivo stakeholder quali pagatori, medici e anche aziende farmaceutiche sono chiamati a definire strategie per reinvestire il risparmio generato dall’introduzione dei biosimilari in nuove opportunità di cura per i pazienti.
Disclosures
Financial support: This research was made possible by an educational grant from Sandoz Italia.
Conflict of interest: None of the authors has financial interest related to this study to disclose.
Bibliografia
- 1. Weycker D, Barron R, Edelsberg J et al. Risk and consequences of chemotherapy-induced neutropenic complications in patients receiving daily filgrastim: the importance of duration of prophylaxis. BMC Health Serv Res. 2014;14:189.
- 2. Bennett CL, Djulbegovic B, Norris LB, Armitage JO. Colony-stimulating factors for febrile neutropenia during cancer therapy. N Engl J Med. 2013;368(12):1131–39.
- 3. National Comprehensive Cancer Network. Clinical practice guidelines in oncology (NCCN Guidelines). Prevention and treatment of cancer-related infections. 2017. Disponibile sul sito: https://www.nccn.org/professionals/physician_gls/f_guidelines.asp. Accesso: Dicembre, 2019.
- 4. Culakova E, Thota R, Poniewierski MS et al. Patterns of chemotherapy-associated toxicity and supportive care in U.S. oncology practice: a nationwide prospective cohort study. Cancer Med. 2014;3(2):434–44.
- 5. Italian AIOM Guidelines 2019. Gestione della tossicità ematopoietica in oncologia. Disponibile sul sito: https://www.aiom.it/wp-content/uploads/2019/10/2019_LG_AIOM_Toss_Ematopoietica.pdf Accesso: Gennaio 2020.
- 6. Crawford J, Dale DC, Kuderer NM et al. Risk and timing of neutropenic events in adult cancer patients receiving chemotherapy: the results of a prospective nationwide study of oncology practice. J Natl Compr Canc Netw. 2008;6(2):109–18.
- 7. Kuderer NM, Dale DC, Crawford J et al. Mortality, morbidity, and cost associated with febrile neutropenia in adult cancer patients. Cancer. 2006;106(10):2258–66.
- 8. Dulisse B, Li X, Gayle JA et al. A retrospective study of the clinical and economic burden during hospitalizations among cancer patients with febrile neutropenia. J Med Econ. 2013;16(6):720–35.
- 9. Michels SL, Barron RL, Reynolds MW et al. Costs associated with febrile neutropenia in the U.S. Pharmacoeconomics. 2012;30(9):809–23.
- 10. Lyman GH, Dale DC, Crawford J. Incidence and predictors of low dose-intensity in adjuvant breast cancer chemotherapy: a nationwide study of community practices. J Clin Oncol. 2003;21(24):4524–31.
- 11. Shayne M, Crawford J, Dale DC et al. Predictors of reduced dose intensity in patients with early-stage breast cancer receiving adjuvant chemotherapy. Breast Cancer Res Treat. 2006;100(3):255–62.
- 12. National Comprehensive Cancer Network. Clinical practice guidelines in oncology (NCCN Guidelines). Myeloid growth factors. 2017. Disponibile sul sito: https://www.nccn.org/professionals/physician_gls/f_guidelines.asp. Accesso: Dicembre 2018.
- 13. Smith TJ, Bohlke K, Lyman GH et al. Recommendations for the use of WBC growth factors: American Society of Clinical Oncology Clinical Practice Guideline update. J Clin Oncol. 2015;33(28):3199–212.
- 14. Aapro MS, Bohlius J, Cameron DA et al. 2010 update of EORTC guidelines for the use of granulocyte-colony stimulating factor to reduce the incidence of chemotherapy-induced febrile neutropenia in adult patients with lymphoproliferative disorders and solid tumours. Eur J Cancer. 2011;47(1):8–32.
- 15. Aapro M, Boccia R, Leonard R et al. Refining the role of pegfilgrastim (a long-acting G-CSF) for prevention of chemotherapy-induced febrile neutropenia: consensus guidance recommendations. Support Care Cancer. 2017;25(11):3295–304.
- 16. Shimazaki C, Oku N, Uchiyama H et al. Effect of granulocyte colony-stimulating factor on hematopoietic recovery after peripheral blood progenitor cell transplantation. Bone Marrow Transplant. 1994;13(3):271–5.
- 17. Vanderpuye-Orgle J, Sexton Ward A, Huber C et al. Estimating the social value of G-CSF therapies in the United States. Am J Manag Care. 2016;22(10):e343–9.
- 18. Edelsberg J, Weycker D, Bensink M et al. Prophilaxis of febrile neutropenia with colony-stimulating factors: the first 25 years. Curr Med Res Opin. 2019;29:1–13.
- 19. Chen ML, Shah V, Patnaik Ret al. Bioavailability and bioequivalence: an FDA regulatory overview. Pharm Res. 2001;18:1645–50.
- 20. European Medicine Agency. Committee for Medicinal Products for Human Use (CHMP). Guidelines on Similar Biological Medicinal Products. CHMP/437/04, London, 2005. Disponibile sul sito: http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500003517.pdf. Accesso: Dicembre 2019.
- 21. European Medicine Agency. Guidelines on Similar Biological Medicinal Products, 2014. Disponibile sul sito: http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2013/05/WC500142978.pdf. Accesso: Dicembre 2019.
- 22. European Medicine Agency. Guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: non-clinical and clinical issues, 2013. Disponibile sul sito: http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2013/06/WC500144124.pdf. Accesso: Dicembre 2019.
- 23. Farmaci Biologici E Biosimilari. Scenari terapeutici e stima del risparmio per il Sistema Sanitario italiano. Centro Studi ICVIA Italia. Disponibile sul sito: http://magazine.imshealth.it/report/(IQVIA)_Farmaci_biologici_e_biosimilari.pdf. Accesso: Marzo 2019.
- 24. Sandoz, data on File.
- 25. Mauskopf JA, Sullivan SD, Annemans L et al. Principles of good practice for budget impact analysis: report of the ISPOR Task Force on Good Research Practices—budget impact analysis. Value Health. 2007;10(5):336–47.
- 26. Sullivan SD, Mauskopf JA, Augustovski F et al. Budget impact analysis principles of good practice: report of the ISPOR 2012 Budget Impact Analysis Good Practice II Task Force. Value Health. 2014;17(1):5–14.
- 27. Marcellusi R, Viti R, Capone A et al. Costi diretti e indiretti assorbiti dalle patologie HCV-indotte in Italia: stima basata su una metodologia probabilistica di Cost of Illness. PharmacoEcon Ital Res Artic. 2014, online, DOI 10.1007/s40276-014-0023-9.
- 28. McBride A, Campbell K, Bikkina M et al. Cost-efficiency analyses for the US of biosimilar filgrastim-sndz, reference filgrastim, pegfilgrastim, and pegfilgrastim with on-body injector in the prophylaxis of chemotherapy-induced (febrile) neutropenia. J Med Econ. 2017 Oct;20(10):1083–93.
- 29. Sun D, Andayani TM, Altyar A et al. Potential cost savings from chemotherapy-induced febrile neutropenia with biosimilar filgrastim and expanded access to targeted antineoplastic treatment across the European Union G5 countries: a simulation study. Clin Ther. 2015 Apr 1;37(4):842–57.