 |
AboutOpen | 2019; 5(1); 5–15
REVIEW |
 |
La gestione dell’infiammazione in oftalmologia: nuove evidenze per la chirurgia della cataratta e oltre
Inflammation management in ophthalmology: new evidences for cataract surgery and beyond
Inflammation represents the manifestation of the host’s vascular and cellular response to tissue damage, hypersensitivity of the immune system or autoimmunity. As soon as the damage is detected, the mechanisms of localization and removal of foreign substances and damaged tissues are triggered. This response is amplified by the activation of inflammatory cells and by the production of chemical mediators derived from arachidonic acid, vasoactive substances and cytokines.
At the ocular level, among the different responses implemented by various inflammation mediators, the action of prostaglandins is mainly expressed in three ways: i) change of intraocular pressure; ii) induction of miosis; iii) increase of protein concentration in the aqueous humor.
Ocular inflammation may continue long after the cessation of the initial cause and may also lead to serious consequences, including permanent vision reduction. For this reason, it is essential to establish a correct and effective therapeutic strategy, which allows to control inflammation, the symptoms and the clinical signs associated with it.
This article therefore deals with therapeutic strategies to control inflammation, with a particular focus on the role of nonsteroidal anti-inflammatory drugs (NSAIDs) in cataract surgery.
Keywords: Bromfenac, Cataract surgery, Inflammation management, NSAIDs.
Received: December 12, 2018
Accepted: January 17, 2019
Published online: April 15, 2019
© 2019 The Authors. This article is published by AboutScience and licensed under Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC-ND 4.0). Any commercial use is not permitted and is subject to Publisher’s permissions. Full information is available at www.aboutscience.eu.
Introduzione: infiammazione e FANS in oftalmologia
Infiammazione in oftalmologia
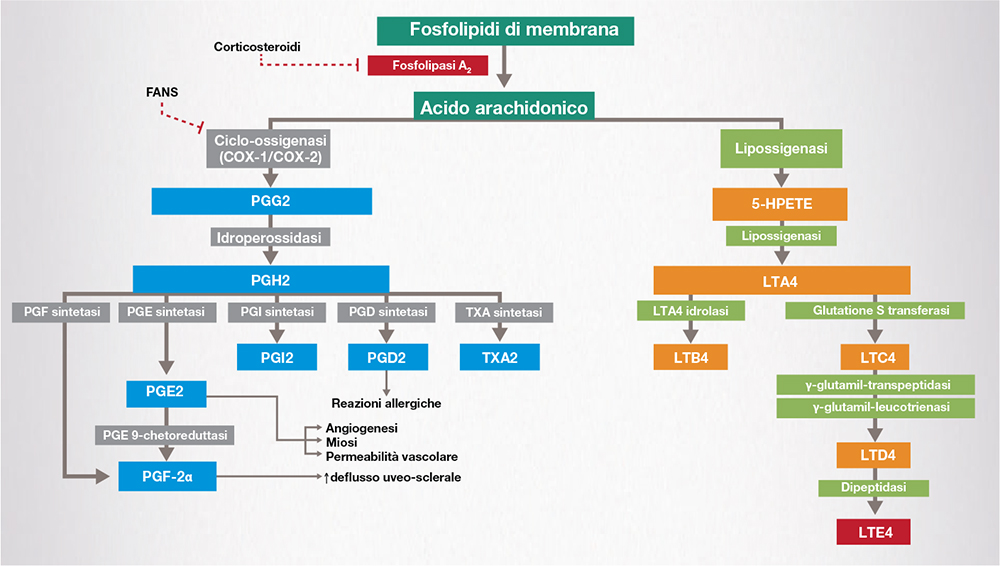
L’infiammazione rappresenta la manifestazione della risposta vascolare e cellulare dell’ospite a un danno tissutale – insulto –, che può essere inflitto da agenti fisici o chimici, da un’invasione di patogeni, da un insulto ischemico, o un’attività eccessiva (ipersensibilità) o inappropriata (autoimmunità) del sistema immunitario. L’infiammazione facilita la risposta immunitaria e la successiva rimozione dell’insulto o del tessuto danneggiato. Non appena il danno viene rilevato, si innescano i meccanismi di localizzazione e rimozione delle sostanze estranee e dei tessuti danneggiati. Tale risposta viene amplificata dall’attivazione delle cellule infiammatorie e dalla produzione di mediatori chimici derivati dall’acido arachidonico (quali prostaglandine, trombossani e leucotrieni), sostanze vasoattive e citochine. L’acido arachidonico viene rilasciato dalla componente fosfolipidica della membrana cellulare per azione della fosfolipasi A2, ed entra nelle vie della prostaglandina-endoperossido sintasi (impropriamente definita ciclo-ossigenasi) e della lipossigenasi, dando luogo rispettivamente a prostaglandine e trombossani o leucotrieni [1].
A livello oculare, tra le diverse risposte messe in atto dai molteplici mediatori dell’infiammazione, l’azione delle prostaglandine (PG) si esplica principalmente in tre modi:
1. Modifica della pressione intraoculare:
a. PGE1 e PGE2 aumentano la pressione endoculare per effetto della vasodilatazione locale e dell’aumentata permeabilità;
b. PGF2 riduce la pressione intraoculare per effetto del deflusso uveo-sclerale.
2. Induzione della miosi per effetto sulla muscolatura liscia dell’iride;
3. Aumento della concentrazione proteica dell’umore acqueo, per effetto dell’aumentata permeabilità vascolare [1].
Inoltre, le PG amplificano l’azione di altri mediatori solubili, inducendo tra l’altro l’espressione del vascular endothelial growth factor (VEGF), importante nello sviluppo della retinopatia diabetica proliferativa e della degenerazione maculare neovascolare legata all’età [2].
L’infiammazione oculare può continuare a lungo dopo la cessazione della causa iniziale e comportare anche gravi conseguenze, inclusa la permanente riduzione della capacità visiva [3].
Per questo motivo è fondamentale instaurare una corretta ed efficace strategia terapeutica, che permetta di controllare l’infiammazione, la sintomatologia e i segni clinici a essa associati.
Strategie terapeutiche per il controllo dell’infiammazione
Due sono le principali classi di farmaci antinfiammatori utilizzati in oftalmologia, entrambi agenti, seppure a livelli diversi, sulla cascata dell’acido arachidonico. Queste sono: i corticosteroidi, che operano tra l’altro bloccando la fosfolipasi A2 per inibire a monte il rilascio di acido arachidonico, e quindi la produzione di prostaglandine, trombossani e leucotrieni, e i farmaci antinfiammatori non steroidei (FANS), che agiscono a valle inibendo le ciclo-ossigenasi (COX-1 e COX-2) e bloccando quindi la produzione di prostaglandine e trombossani [1,3].
In particolare, i corticosteroidi, sebbene considerati per lungo tempo il gold standard per il trattamento dell’infiammazione oculare, si associano a una serie di effetti collaterali da non sottovalutare, specie nell’utilizzo in post-chirurgia, quali l’aumento della pressione intraoculare (IOP), l’aumentata suscettibilità alle infezioni microbiche a causa dell’azione immunosoppressiva, l’assottigliamento sclerale e corneale e il ritardo nella guarigione della ferita chirurgica. Il loro utilizzo prolungato comporta inoltre il rischio di sviluppare glaucoma, difetti dell’acuità visiva, perdita di campo visivo e formazione di cataratta sottocapsulare posteriore [3].
Sono state quindi individuate alternative terapeutiche per la gestione del dolore e dell’infiammazione oculare post-chirurgici, dotate di efficacia sovrapponibile agli steroidi e associate a un rischio inferiore di complicanze. Tra queste, la classe di farmaci principalmente utilizzata per il trattamento dell’infiammazione oculare è quella dei FANS [3].
Il ruolo dei FANS in oftalmologia si basa sulla dimostrazione della loro efficacia in diversi ambiti [2]:
- riduzione dell’infiammazione,
- prevenzione della miosi intraoperatoria,
- prevenzione e trattamento dell’edema maculare cistoide (associato alla chirurgia della cataratta),
- riduzione del dolore post-operatorio,
- riduzione della fotofobia associata alla chirurgia refrattiva,
- riduzione del prurito associato alla congiuntivite allergica,
- effetti terapeutici per la retinopatia diabetica e la degenerazione maculare senile.
Viste le proprietà farmacologiche di queste due classi di farmaci ad azione antinfiammatoria, l’associazione di FANS e corticosteroidi è giustificata dal diverso meccanismo d’azione che garantisce un effetto sinergico (Fig. 1) [2].
Razionale dell’utilizzo dei FANS nella terapia post-chirurgica
Il trauma associato a un intervento di chirurgia oculare può scatenare una risposta infiammatoria, inducendo il rilascio di PG, il reclutamento di neutrofili e macrofagi e la produzione di mediatori dell’infiammazione [4]. L’infiammazione post-operatoria determina tipicamente una lieve irite con presenza di cellule e flare in camera anteriore e, nei casi più gravi, una significativa riduzione dell’acuità visiva, oltre che dolore, rossore e/o gonfiore perioculare [5].
L’impiego di agenti farmacologici in grado di inibire la risposta infiammatoria, quali i FANS, può ridurre le complicanze infiammatorie della chirurgia oftalmica [4]. I principali ambiti chirurgici di impiego dei FANS sono i seguenti:
a. chirurgia della cataratta,
b. chirurgia del glaucoma,
c. chirurgia vitreo-retinica.
Nei prossimi capitoli affronteremo in dettaglio questi aspetti.
Farmacologia dei FANS per uso oftalmico
I FANS ʻsono un gruppo eterogeneo di molecole, suddivisi in classi principali diverse su base chimica quali salicilati, derivati dell’acido indolacetico, derivati dell’acido arilacetico, derivati dell’acido arilpropionico, derivati dell’acido enolico e fenammati. Le formulazioni per uso topico sono disponibili solo per le classi dotate di maggiore solubilità in acqua, quali i derivati dell’acido indolacetico, dell’acido arilacetico e dell’acido arilpropionico [2].
La maggior parte dei FANS sono farmaci lievemente acidi, che vanno incontro a ionizzazione al pH del fluido lacrimale. Questo ne limita la permeabilità attraverso la cornea, che presenta un punto isoelettrico (pI) di 3,2. Sebbene riducendo il pH sia possibile aumentarne la penetrazione attraverso la cornea, l’ulteriore acidificazione rende questi farmaci potenzialmente irritanti, riducendone inoltre la solubilità in acqua. Lo sviluppo di formulazioni di FANS per uso topico a livello oculare è stato quindi particolarmente difficoltoso. Attualmente in Europa vari FANS sono approvati per il trattamento dell’infiammazione dopo chirurgia della cataratta (Tabella 1) [3].
Perché un agente topico sia efficace, deve essere dotato non solo di una potenza sufficiente, ma anche della capacità di penetrare nei tessuti infiammati. L’instillazione oculare dei diversi FANS per uso topico garantisce una concentrazione del farmaco a livello dei tessuti oculari e dell’umore acqueo sufficiente per inibire la sintesi delle PG e quindi esercitare un’azione antinfiammatoria; l’entità di tale azione dipende dal grado di penetrazione dei diversi FANS, che a sua volta è influenzato dalla struttura della molecola e dalle proprietà farmacocinetiche che ne derivano [6]:
- diclofenac: nella forma usuale di acido fenil-acetico, diclofenac presenta una scarsa solubilità in acqua; viene quindi utilizzato sotto forma di sale sodico per aumentarne la solubilità. Inoltre, al pH fisiologico dell’occhio, diclofenac presenta una scarsa permeabilità e deve essere tamponato a un pH più basso (6,0) per aumentare la capacità di penetrazione corneale. Poiché tuttavia riducendo il pH si provoca la precipitazione della soluzione, è necessario utilizzare degli stabilizzanti. Per aumentare la solubilità in acqua e la penetrazione corneale è stata creata una formulazione oleosa del farmaco [7];
- flurbiprofene: la molecola di flurbiprofene è sostanzialmente insolubile in acqua. La capacità di penetrazione è massima a pH 6,4 e si riduce avvicinandosi al range di pH fisiologico. La penetrazione corneale migliora anche in presenza di benzalconio cloruro (BAK) per aumento della lipofilia, così come dopo aggiunta di nitrato fenil-mercurico o ciclodestrina [7];
- ketorolac: disponibile in commercio sotto forma di sale trometaminico, che presenta una migliore solubilità in acqua rispetto alla molecola nativa; è tuttavia estremamente irritante per la superficie oculare, per cui è utilizzata a concentrazioni ridotte (0,4%). Poiché riducendo il pH si ottiene un aumento della penetrazione corneale del farmaco, le formulazioni attualmente disponibili sono preparate in un tampone fosfato che abbassa il pH a 4,5 (comportando tuttavia il rischio di ridurre l’efficacia della molecola, più stabile a pH più elevati). Anche l’aggiunta di BAK può aumentare la penetrazione corneale, ma si associa a un maggiore rischio di irritazione della superficie oculare. Ketorolac è l’unico FANS topico disponibile in formulazione priva di conservanti, che può risultare meglio tollerata nei pazienti più sensibili a questi additivi quali il BAK [7];
- nepafenac: si tratta di un pro-farmaco che penetra rapidamente nella cornea (6 volte più velocemente rispetto a diclofenac in vitro). Una volta raggiunto l’umore acqueo, viene deaminato dalle idrolasi intraoculari ad amfenac, che esercita una potente azione inibitoria a carico delle COX-1 e 2 (maggiore rispetto a ketorolac e diclofenac) [7];
- bromfenac: la molecola di bromfenac è stata studiata in modo da aumentarne la lipofilia, migliorare la penetrazione corneale, prolungare la durata d’azione e incrementare l’azione inibitoria a carico della COX-2 (che risulta rispettivamente 3,7, 6,5 e 18 volte maggiore rispetto a diclofenac, amfenac e ketorolac [7].
| Nome commerciale (principio attivo) | Formulazione | Dosaggio |
|---|---|---|
| Acular® (ketorolac) | Soluzione 0,5% | Tid |
| Voltaren® (diclofenac) | Soluzione 0,1% | Qid |
| Nevanac® (nepafenac) | Sospensione 0,1% | Tid |
| Ocufen® (flurbiprofene) | Soluzione 0,03% | Qid |
| Indocollirio® (indometacina) | Soluzione 0,1% | Qid |
| Yellox® (bromfenac) | Soluzione 1 mg/ml collirio | Bid |
Bid = 2 volte al giorno; Tid = 3 volte al giorno/die; Qid = 4 volte al giorno
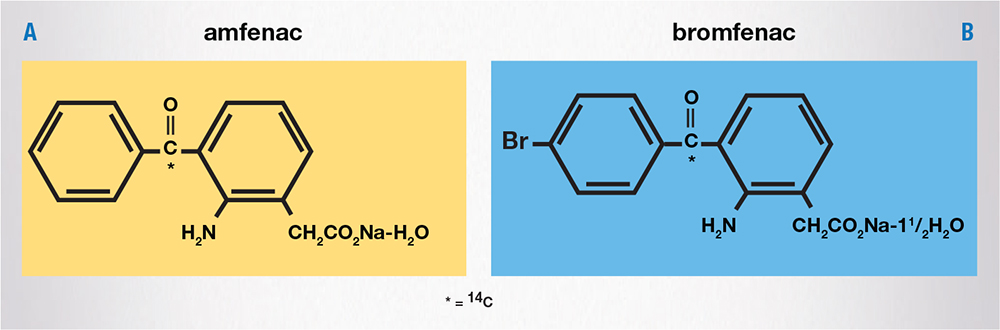
Vari studi che hanno analizzato le proprietà fisico-chimiche dei derivati dell’acido arilacetico (diclofenac, ketorolac, nepafenac e bromfenac) hanno evidenziato infatti che l’aggiunta di un gruppo alogeno all’anello aromatico determina un aumento dell’attività antinfiammatoria: in particolare i composti più potenti sono quelli con un gruppo alogeno in posizione 4’. Bromfenac differisce da amfenac per la presenza di un atomo di bromo in posizione 4’ dell’anello benzolico (Fig. 2): quest’ultimo conferisce alla molecola maggior potere antinfiammatorio e aumentata lipofilia, e dunque maggiore capacità di penetrare nei tessuti oculari [6,8].
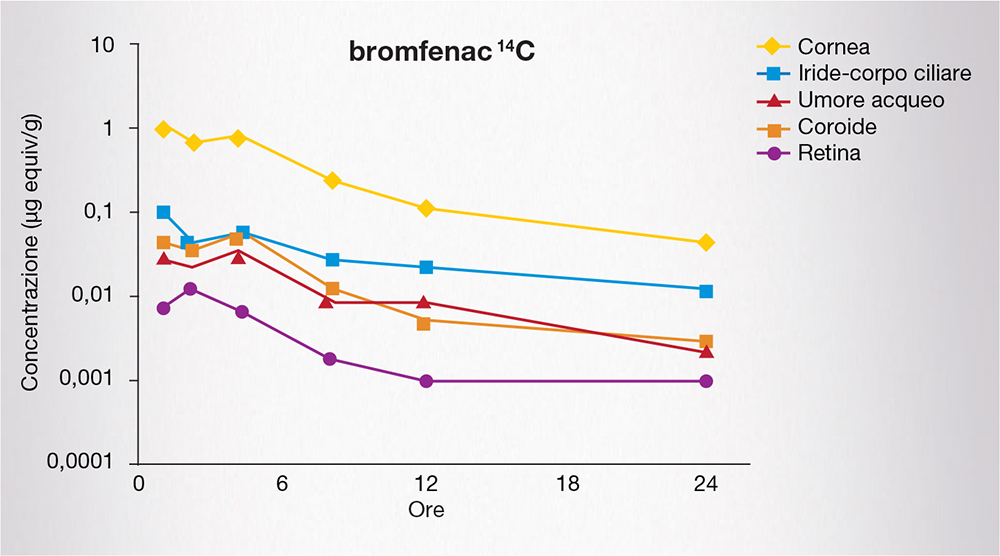
Uno studio condotto nel coniglio ha infatti dimostrato che bromfenac è riscontrabile nell’umore acqueo e nella maggior parte dei tessuti oculari (comprese sclera, coroide e retina) entro 2 ore e fino a 24 ore dopo una singola instillazione (Fig. 3) [6].
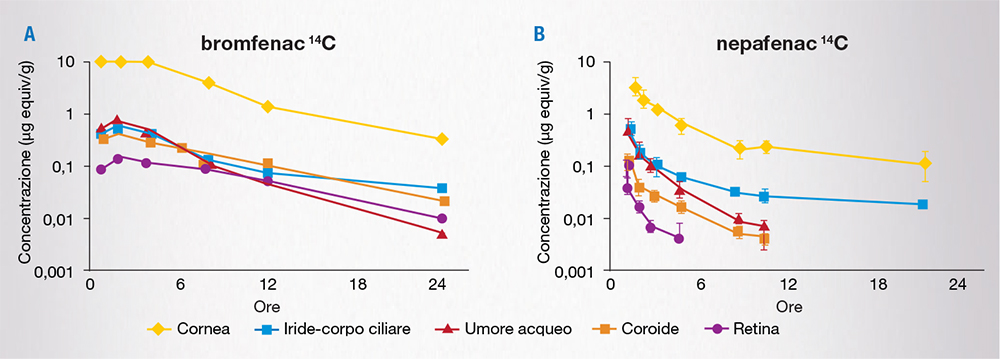
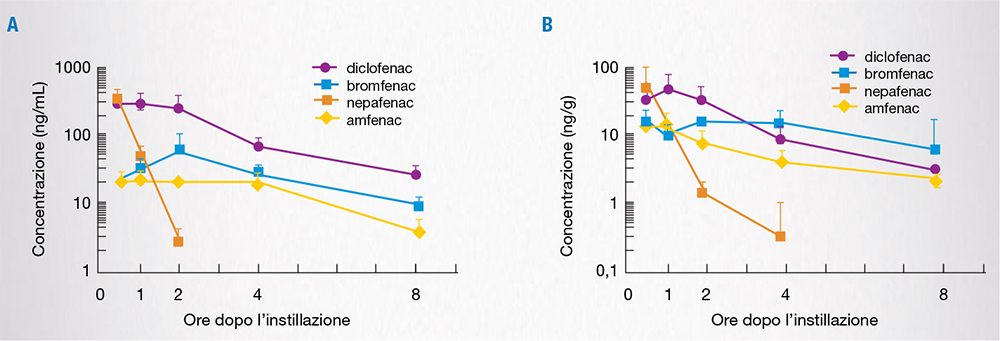
Uno studio simile, di confronto tra nepafenac e bromfenac, somministrati nel coniglio a una concentrazione 3 volte superiore a quella autorizzata nell’uomo, ha evidenziato che bromfenac in soluzione oftalmica raggiunge concentrazioni rilevabili entro 2 ore, che si mantengono elevate fino a 24 ore nella maggior parte dei tessuti oculari (umore acqueo, cornea, iride-corpo ciliare, coroide, retina) [Fig. 4A]. Al contrario, nepafenac raggiunge livelli rilevabili a 24 ore solo nella cornea e nell’iride-corpo ciliare, mentre non sono riscontrabili livelli significativi nella retina dopo 6 ore e nell’umore acqueo e nella coroide dopo 12 ore (Fig. 4B) [6].
Uno studio recente ha confrontato la farmacocinetica di vari FANS (diclofenac, bromfenac e amfenac) a livello dell’umore acqueo e della corioretina nel coniglio, rilevando che, sebbene a livello dell’umore acqueo diclofenac raggiunga concentrazioni più elevate rispetto a bromfenac e amfenac (che sono comunque in grado di permanere a lungo in questa sede), nella corioretina bromfenac raggiunge concentrazioni più elevate rispetto a diclofenac e nepafenac (Fig. 5) [9].
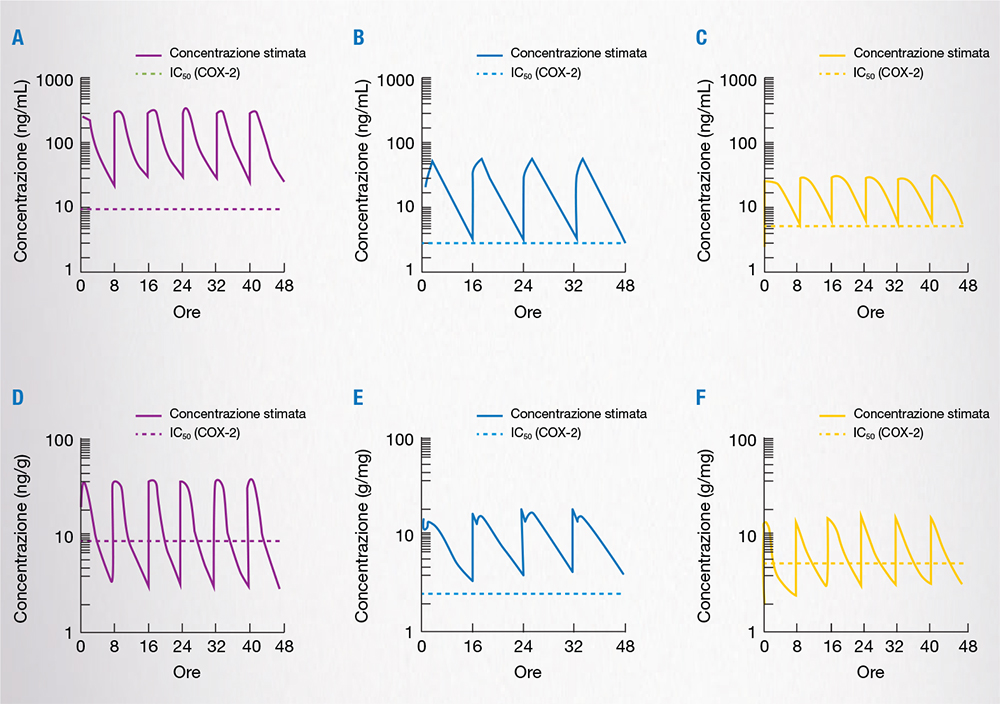
Sebbene a livello dell’umore acqueo la concentrazione dei tre FANS si sia mantenuta sempre al di sopra della IC50 di ciascun farmaco per la COX-2, a livello della corioretina la somministrazione di bromfenac 2 volte al giorno ha garantito concentrazioni superiori all’IC50 per la COX-2 per tutte le 48 ore di analisi, mentre la somministrazione di diclofenac o amfenac, 3 volte al giorno, si è associata a concentrazioni inferiori all’IC50 per la COX-2 in corrispondenza dei trough level (Fig. 6) [9].
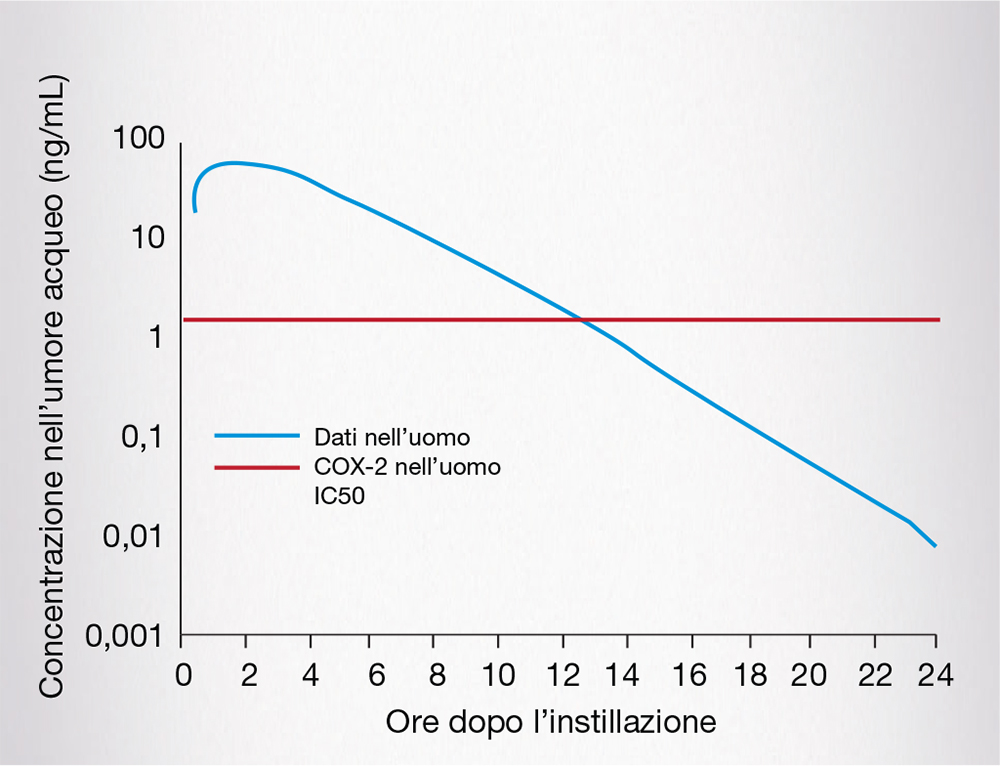
Questi risultati sono stati confermati anche nell’uomo: uno studio condotto in 54 soggetti sottoposti a chirurgia della cataratta ha valutato la farmacocinetica di bromfenac sodico 0,1%, somministrato a diversi timepoint 30-345 minuti prima dell’intervento: la concentrazione del farmaco a livello dell’umore acqueo ha raggiunto il picco dopo 2,5-3,0 ore dall’instillazione e si è mantenuta al di sopra dell’IC50 per la COX-2 per 12 ore. Una simulazione computerizzata ha inoltre stimato la persistenza di concentrazioni rilevabili del farmaco per 24 ore (Fig. 7) [6].
Per quanto riguarda la potenza antinfiammatoria e antidolorifica dei diversi FANS, dipendente dall’azione inibitoria sulle ciclo-ossigenasi, bromfenac presenta un’azione inibitoria sulla COX-1 e sulla COX-2 rispettivamente 10 e 4,1 volte superiore rispetto a diclofenac, e 2,8 e 2,7 maggiore di amfenac (Tabella 2) [9]).
| IC50 (nM) [Intervallo di confidenza 95%] | |||
|---|---|---|---|
| Principio attivo | COX-1 | COX-2 | Ratio di IC50 |
| diclofenac | 55,5 [19,6-158] | 30,7 [19,1-50,5] | 0,55 |
| bromfenac | 5,56 [3,55-8,83] | 7,45 [4,58-12,0] | 1,3 |
| amfenac | 15,3 [10,6-22,2] | 20,4 [14,7-27,9] | 1,3 |
Key messages
- Due sono le principali classi di farmaci antinfiammatori utilizzati in oftalmologia, entrambe agenti, seppure a livelli diversi, sulla cascata dell’acido arachidonico: i corticosteroidi, che operano bloccando tra l’altro la fosfolipasi A2, e i farmaci antinfiammatori non steroidei (FANS), che agiscono a valle inibendo la ciclo-ossigenasi.
- L’impiego di agenti farmacologici in grado di inibire la risposta infiammatoria, quali i FANS, può ridurre le complicanze infiammatorie della chirurgia oftalmica, limitando la comparsa di eventi avversi.
- Tra i FANS attualmente disponibili in commercio, bromfenac presenta una rapida penetrazione nei tessuti oculari e una potente azione inibitoria esercitata sulla COX-2, enzima chiave nella genesi delle complicanze oculari mediate dalle prostaglandine.
FANS e chirurgia della cataratta
La facoemulsificazione con impianto di lenti intraoculari (IOL) è attualmente la procedura chirurgica di scelta per il trattamento della cataratta, offrendo i migliori risultati in termini di recupero del visus. Tuttavia, nonostante i progressi nelle tecniche chirurgiche (incisione corneale di minori dimensioni, nuove procedure a ultrasuoni) e i miglioramenti nelle caratteristiche delle IOL (materiali acrilici idrofobici), le complicazioni legate all’infiammazione post-chirurgica rimangono frequenti e spesso impediscono di raggiungere risultati ottimali in termini di capacità visiva [10].
Il trauma oculare provocato durante l’intervento chirurgico innesca la cascata infiammatoria con il conseguente rilascio di un gran numero di mediatori che portano all’attivazione di COX-1 e COX-2, e alla produzione di PG, responsabili a loro volta di un’ampia serie di segni e sintomi oculari, quali dolore, iperemia congiuntivale, miosi, variazioni della pressione intraoculare, glaucoma, sinechie, opacità capsulare posteriore, edema maculare cistoide (EMC) [10].
I FANS, grazie alla loro azione inibitoria su COX-1 e COX-2 rappresentano una valida opzione terapeutica per il controllo dei segni e sintomi oculari conseguenti alla chirurgia della cataratta. Il loro impiego può essere preso in considerazione in alternativa ai corticosteroidi, rispetto ai quali presentano il vantaggio di una maggiore tollerabilità, o in associazione ad essi, con il beneficio di ottenere un effetto sinergico derivante dall’azione combinata su meccanismi d’azione diversi [10].
Secondo l’American Society of Cataract and Refractive Surgery (ASCRS), l’utilizzo dei FANS, in monoterapia (soprattutto in pazienti a rischio di eventi avversi) o in associazione agli steroidi (sfruttando l’azione sinergica), è efficace nel ridurre il dolore e nel modulare l’infiammazione post-operatoria, oltre a prevenire la miosi intraoperatoria e ridurre l’incidenza di EMC [7].
Azione antinfiammatoria
È ormai appurato che i FANS per uso topico riducono l’infiammazione post-operatoria associata a chirurgia della cataratta. Numerosi studi prospettici randomizzati, in doppio cieco, controllati con placebo o con controllo attivo, condotti su un numero adeguato di pazienti, hanno dimostrato che la somministrazione topica di indometacina 1%, flurbiprofene 0,03%, ketorolac 0,4% e 0,5%, diclofenac 0,1%, nepafenac 0,1% e bromfenac 0,09% riduce l’infiammazione post-operatoria dopo chirurgia della cataratta. Tuttavia, solo 4 di questi farmaci (diclofenac, ketorolac, nepafenac e bromfenac) sono stati approvati per questa indicazione [2].
I FANS per uso topico sembrano inoltre in grado di ridurre al minimo il fastidio oculare dopo chirurgia retinica e di cataratta: studi prospettici randomizzati hanno dimostrato un effetto di questo tipo per diclofenac 0,1%, ketorolac 0,4%, nepafenac 0,1% e bromfenac 0,09% [2].
In particolare, due studi clinici di fase III multicentrici, randomizzati in doppio cieco, hanno valutato l’efficacia e la sicurezza di bromfenac soluzione oftalmica 0,09% (n = 356) versus placebo (n = 171) nel controllo dell’infiammazione e del dolore post-chirurgici in pazienti sottoposti a intervento di cataratta (senza precedente trattamento antinfiammatorio), in termini di SOIS (summed ocular inflammation score), livelli di infiammazione, tempo di risoluzione dal dolore ed eventi avversi [11].
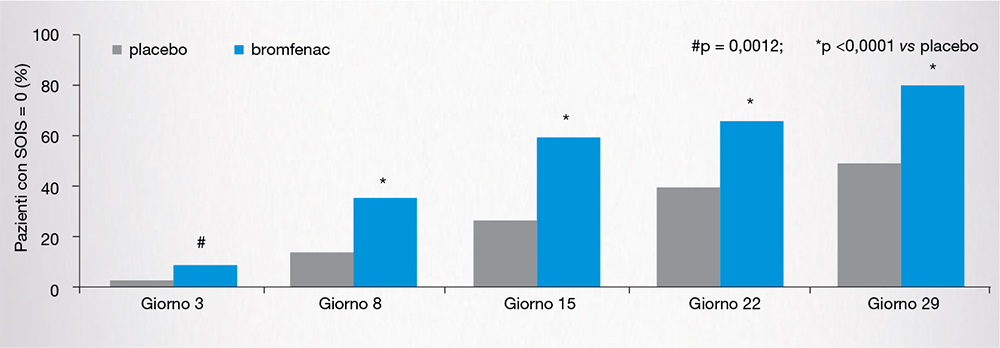
Nell’8,4% dei pazienti trattati con bromfenac è stata osservata una risoluzione dell’infiammazione entro 3 giorni dall’inizio del trattamento (rispetto all’1,2% con placebo, p = 0,0012) [Fig. 8] [11]. Una percentuale maggiore di pazienti trattati con bromfenac (64%) rispetto a quelli riceventi placebo (43,3%) ha raggiunto la completa risoluzione dell’infiammazione oculare entro il giorno 15 (p < 0,0001), con un tempo mediano alla risoluzione di 2 giorni con bromfenac versus 5 giorni con placebo (p < 0,0001) [11]. L’incidenza di eventi avversi è stata inferiore nel gruppo bromfenac rispetto al placebo (33,7% vs 47,4%; p = 0,0027) [Tabella 3] [11].
| Gruppi di trattamento | ||
|---|---|---|
| Evento avverso | bromfenac (n = 356) [%] | placebo (n = 171) [%] |
| Irite | 7,0 | 18,1 |
| Sensazione
oculare anormale |
6,5 | 8,2 |
| Dolore oculare | 4,2 | 11,7 |
| Prurito oculare | 3,9 | 2,9 |
| Opacizzazione capsulare posteriore | 3,9 | 4,1 |
| Irritazione oculare (dolore/bruciore) | 2,5 | 4,7 |
| Arrossamento oculare | 2,2 | 7,6 |
| Iperemia congiuntivale | 2,2 | 11,1 |
| Fotofobia | 2,0 | 11,1 |
| Edema maculare | 1,4 | 4,7 |
L’analisi dei dati di sicurezza sistemica raccolti nell’ambito di questi studi ha evidenziato inoltre l’assenza di eventi avversi sistemici, così come di segni di tossicità epatica durante il trattamento con bromfenac soluzione oftalmica 0,09% [12].
Rispetto ad altri FANS, l’effetto finale in termini di riduzione dell’infiammazione è confrontabile, ma bromfenac dimostra una più rapida insorgenza dell’azione antinfiammatoria [6]. Rispetto a ketorolac, bromfenac è stato meglio tollerato [6].
Alcuni studi hanno inoltre dimostrato che il trattamento con FANS ha un effetto positivo anche sull’acuità visiva dopo chirurgia della cataratta o interventi retinici [2].
Sebbene studi di confronto diretto tra FANS e corticosteroidi non abbiano rilevato differenze sostanziali in termini di riduzione dell’infiammazione intraoculare dopo chirurgia della cataratta, i FANS sembrano essere più efficaci nel ristabilire la barriera emato-acquosa. Ci sono quindi sufficienti evidenze a supporto dell’utilizzo dei FANS al posto dei corticosteroidi o in aggiunta ad essi dopo chirurgia della cataratta per evitare una eccessiva risposta infiammatoria o per migliorare il recupero del visus [2].
Alcuni studi suggeriscono inoltre potenziali vantaggi associati all’impiego topico di FANS fino a 3 giorni prima della chirurgia della cataratta [2].
Prevenzione della miosi intraoperatoria
La miosi indotta dal trauma chirurgico, principalmente a carico dell’iride, è causata dal rilascio di PG. Se il rilascio di PG è inibito tramite l’impiego di FANS per uso topico, viene mantenuta la midriasi durante la procedura chirurgica, con conseguente riduzione delle complicanze intraoperatorie quali la rottura della capsula posteriore. Attualmente esistono diversi metodi non invasivi per prevenire la miosi durante l’intervento chirurgico, tuttavia l’utilizzo di FANS topici pre-operatori in associazione con gli agenti midriatici tradizionali (anticolinergici e simpatico-mimetici) è molto diffuso [10].
Numerosi studi clinici hanno dimostrato il ruolo svolto dai principali FANS nel mantenimento della midriasi durante la chirurgia della cataratta [2].
In particolare, uno studio prospettico randomizzato condotto su 60 pazienti sottoposti a chirurgia della cataratta con facoemulsificazione trattati con nepafenac 0,1% 3 volte al giorno, dal giorno prima fino a 6 settimane dopo l’intervento, o con tobramicina/desametasone, ha riscontrato una differenza statisticamente significativa (p < 0,001) nel diametro pupillare tra il gruppo trattato con tobramicina/desametasone (6,84 ± 0,93 mm) e quello trattato con nepafenac (7,91 ± 0,74 mm) [Fig. 9] [10].
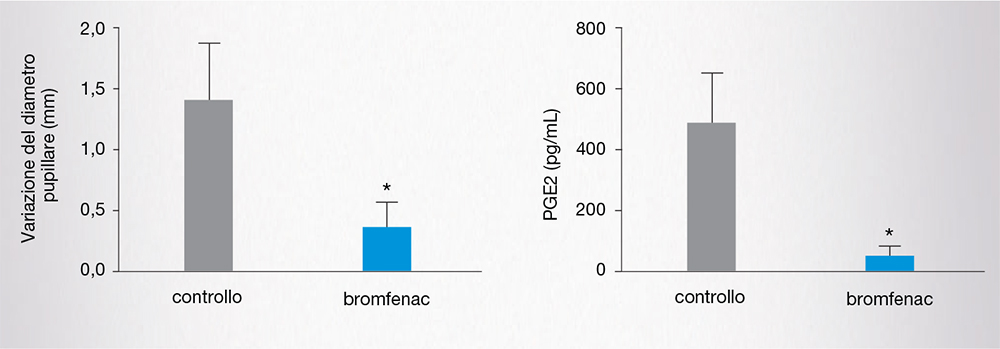
Un recente studio condotto in 60 pazienti sottoposti a chirurgia della cataratta con femto-laser, trattati con bromfenac 0,1% 2 volte al giorno, per 3 giorni prima dell’intervento, ha dimostrato che la variazione del diametro pupillare è inferiore nei pazienti trattati con bromfenac rispetto ai controlli trattati con placebo, con una riduzione significativa dei livelli di PGE2 (Fig. 10) [13].
Uno studio simile, condotto con ketorolac in 42 pazienti sottoposti a chirurgia della cataratta con femto-laser, ha ottenuto risultati del tutto sovrapponibili, rilevando una miosi inferiore nei pazienti sottoposti a un breve trattamento topico prima dell’intervento rispetto ai controlli non trattati [14].
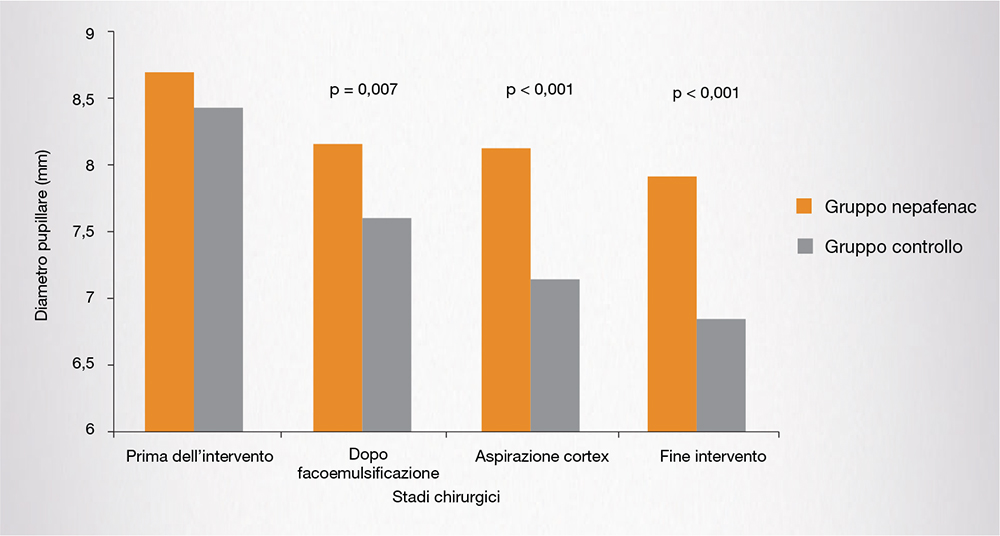
Dall’insieme degli studi disponibili in letteratura emerge che tutti i FANS, se somministrati prima dell’intervento, sono efficaci nel mantenere la midriasi durante la chirurgia della cataratta. Sebbene nessuno studio di comparazione diretta abbia dimostrato la superiorità di un FANS rispetto agli altri, tutti gli studi di confronto rispetto al placebo hanno rilevato che, quando il FANS non viene utilizzato, la miosi intraoperatoria è più marcata.
Prevenzione dell’edema maculare cistoide
L’EMC rappresenta una delle maggiori cause di ridotta acuità visiva dopo intervento di facoemulsificazione non complicato. Lo sviluppo di EMC, che avviene in genere tra la quarta e la sesta settimana dopo l’intervento chirurgico, consegue all’infiammazione, indotta dalle PG e dagli altri mediatori infiammatori e dalla rottura delle barriere emato-retinica ed emato-acquosa [10]. Il rischio di sviluppare EMC è particolarmente elevato nei pazienti diabetici, soprattutto in presenza di edema maculare pre-esistente, retinopatia avanzata, diabete mellito insulino-dipendente da oltre 10 anni: nel 22% dei pazienti con diabete, infatti, si ha un aumento del 30% dello spessore retinico foveale dopo 4 settimane dall’intervento [15,16].
L’incidenza di EMC si è ridotta negli anni in relazione al miglioramento delle tecniche chirurgiche: mentre i report più datati sullo sviluppo di EMC dopo estrazione di cataratta intracapsulare (ICCE) riportano percentuali che raggiungono il 50-70%, nel caso di interventi di estrazione di cataratta extracapsulare (ECCE) la percentuale risulta compresa tra il 16 e il 40%. L’EMC rilevato angiograficamente dopo facoemulsificazione è stato riportato nel 9-19% dei casi [17-19]. Nel 1998, Flach et al. hanno attestato una incidenza di EMC dopo ECCE con impianto di IOL pari al 7% [20], mentre dopo facoemulsificazione senza complicanze l’incidenza di EMC si è abbassata fino allo 0-2% [21]. Recentemente, Loewenstein e Zur (2010) hanno riportato una frequenza di EMC clinicamente rilevante compresa tra 0,1% e 2,5% con l’utilizzo delle tecniche chirurgiche più moderne [22].
L’incidenza dell’EMC, che attualmente varia tra l’1-6% e il 20-30%, si è ridotta anche grazie all’uso dei FANS topici, ormai ampiamente utilizzati nella gestione dei pazienti sottoposti a chirurgia della cataratta, sebbene solo alcuni componenti di questa classe farmaceutica siano stati autorizzati per questa indicazione [10].
Sebbene la patogenesi dell’EMC non sia ancora del tutto chiara, il ruolo dell’infiammazione nello sviluppo di tale condizione è da tempo ampiamente riconosciuto e ha fornito il razionale per l’impiego di farmaci antinfiammatori (corticosteroidi prima e FANS poi) per cercare di ridurre la produzione di PGE a livello dei tessuti oculari [2].
In particolare, i FANS in formulazione per uso oftalmico si sono dimostrati efficaci nella chirurgia della cataratta per mantenere la midriasi, ridurre l’infiammazione, prevenire e trattare l’EMC. Inoltre, sono risultati utili dopo chirurgia refrattiva per ridurre il dolore e la fotofobia, e in caso di congiuntivite allergica per alleviare il prurito. Evidenze crescenti suggeriscono un effetto benefico dei FANS anche per la retinopatia diabetica, la degenerazione maculare senile e i tumori oculari [2].
Sebbene il controllo dell’infiammazione post-chirurgica e la prevenzione dell’EMC siano riconosciuti come elementi chiave nel garantire il successo degli interventi di chirurgia della cataratta, le attuali linee guida non forniscono raccomandazioni specifiche per la gestione post-operatoria dell’infiammazione e per la profilassi dell’EMC [23].
Non c’è infatti allo stato attuale un consenso sulla modalità ottimale di prevenzione dell’EMC [24]. Diversi studi hanno confrontato l’efficacia dei FANS rispetto ai corticosteroidi nel controllare l’infiammazione post-cataratta: secondo una recente review sistematica, nel controllo dell’infiammazione post-chirurgica e nella prevenzione dell’EMC i FANS sono più efficaci dei cortisonici senza aumentare il rischio di eventi avversi, ma non ci sono chiare evidenze su quale sia il FANS più efficace [23]. Da un lato, secondo l’American Academy of Ophthalmology (AAO), non ci sono evidenze sufficienti che supportino benefici per l’acuità visiva a lungo termine della terapia con i FANS quando somministrati da soli o in associazione alla terapia corticosteroidea (il cui effetto sinergico non sembrerebbe supportato dalla letteratura) [25]. D’altra parte, secondo l’ASCRS, l’utilizzo dei FANS, da soli (soprattutto in pazienti a rischio di eventi avversi) o in associazione agli steroidi (sfruttando l’azione sinergica), è efficace nel ridurre il dolore, nel prevenire la miosi intraoperatoria, nel modulare l’infiammazione post-operatoria e nel ridurre l’incidenza di EMC [7].
Alla luce di queste considerazioni, è stato condotto lo studio PREvention of Macular EDema after cataract surgery (PREMED), un trial europeo indipendente, sponsorizzato dalla European Society of Cataract and Refractive Surgery (ESCRS), allo scopo di fornire evidenze cliniche propedeutiche all’elaborazione di linee guida europee per la prevenzione dell’EMC dopo l’intervento di cataratta [24].
I risultati dello studio PREMED hanno dimostrato che bromfenac 0,09% è più efficace di desametasone 0,1% nel prevenire l’ispessimento retinico dopo chirurgia della cataratta (endpoint primario dello studio), confermando i risultati di precedenti metanalisi [23,26,27].
Lo studio non ha rilevato differenze statisticamente significative o clinicamente rilevanti tra il gruppo trattato con bromfenac in monoterapia e quello trattato con la combinazione bromfenac + desametasone in termini di spessore maculare medio e volume maculare complessivo, suggerendo che la combinazione non è in grado di ridurre ulteriormente lo spessore retinico rispetto a quanto ottenuto con bromfenac da solo. Il rischio di sviluppare edema maculare clinicamente significativo (EMCS) entro 12 settimane dall’intervento è risultato ridotto con la combinazione bromfenac + desametasone [24].
L’impiego dei FANS in chirurgia oftalmica in Italia: dati real life
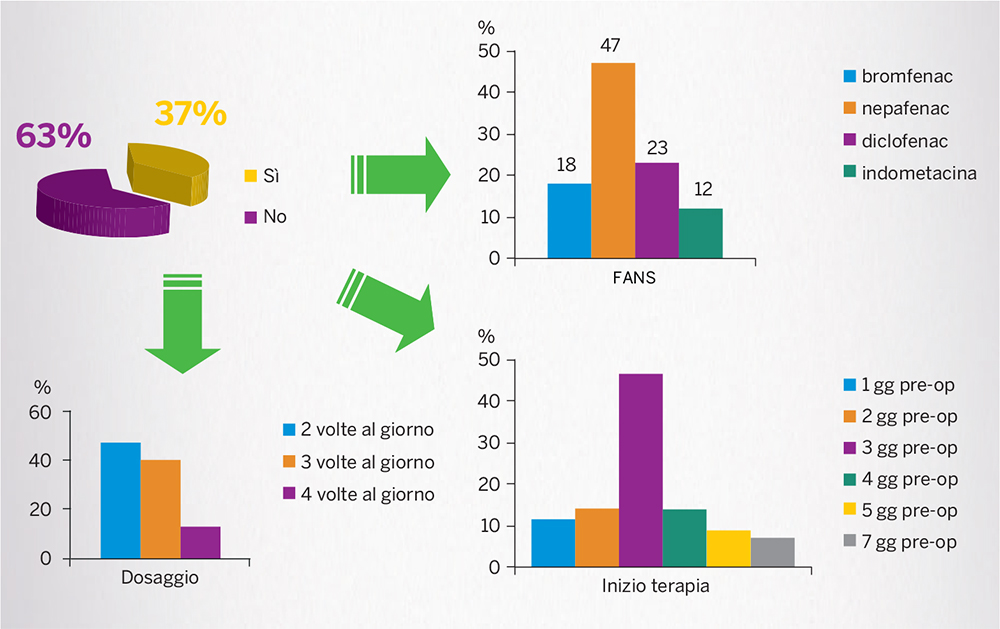
Un’indagine, condotta presso 41 centri italiani (per un totale di 53.900 interventi/anno), ha evidenziato che solo il 37% dei casi viene sottoposto a pre-trattamento con FANS (Fig. 11) [28].
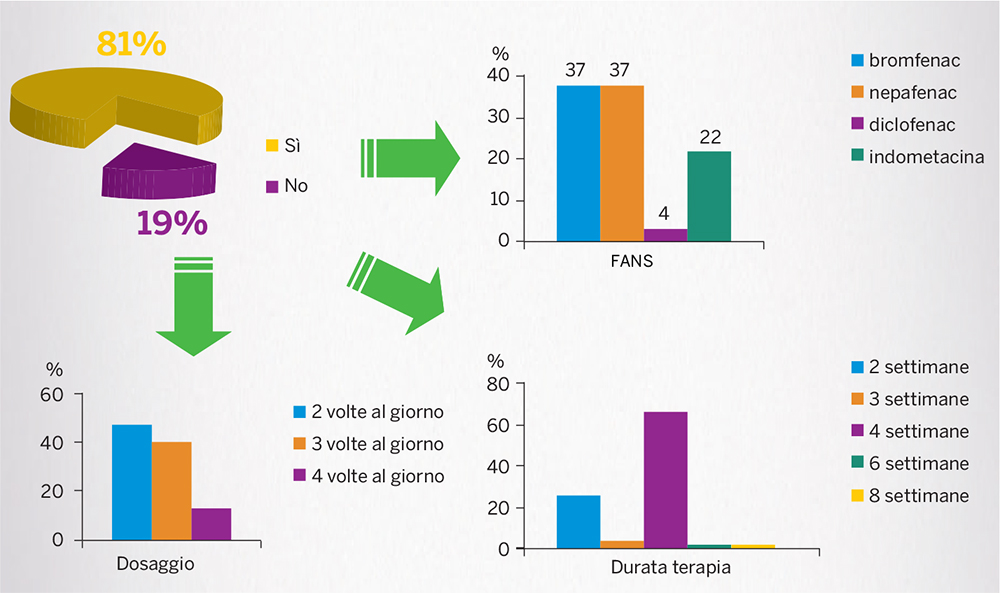
Nel post-operatorio invece l’impiego dei FANS riguarda l’81% dei casi. L’indicazione di nepafenac per la prevenzione dell’EMC può spiegare l’alta percentuale di impiego del farmaco nel post-operatorio (Fig. 12) [28].
Per quanto riguarda i pazienti ad alto rischio, definiti dalla presenza di vari fattori (Tabella 4) [28] e corrispondenti secondo i risultati dell’indagine a circa il 17% della casistica totale (percentuale probabilmente sottostimata, che potrebbe arrivare anche sino al 25% in alcuni centri), l’impiego di FANS praticamente raddoppia, raggiungendo l’86% dei casi nel pre-operatorio.
Sicurezza
L’esperienza post-marketing con i FANS per uso topico suggerisce che il rischio di reazioni avverse a carico della cornea, in grado di compromettere la vista, può aumentare nei pazienti sottoposti a interventi impegnativi sull’occhio e con denervazione corneale, difetti dell’epitelio corneale, diabete mellito e malattie della superficie oculare, ad esempio sindrome dell’occhio secco, artrite reumatoide o ripetuti interventi chirurgici sull’occhio in un breve arco di tempo. I FANS per uso topico devono quindi essere utilizzati con cautela in questi pazienti [29].
| +++ | ++ | + |
|---|---|---|
| Uveite | Edema maculare controlaterale | Scarsa midriasi |
| Diabete | Traumi chirurgici | Pseudoesfoliatio |
| Presenza di edema maculare pre-operatorio | Patologie reumatiche (AR giovanile, artrite idiopatica giovanile) | Maculopatia |
| Patologie infiammatorie pregresse | Complicanze chirurgiche | Patologia erpetica e ulcere corneali |
| Sinechie anteriori con impegno irideo | Cataratta complicata | Alterazione della superficie oculare |
| Occlusione venosa retetinica | Intervento di glaucoma | |
| Distrofia endoteliale | ||
| Terapia sistemica con alfa-litici | ||
| Pazienti in terapia con PG | ||
| Esiti di cheratoplastica | ||
| Aids | ||
| Pazienti post-chemioterapia | ||
| Pazienti vitrectomizzati | ||
| Retinite pigmentosa | ||
| Membrana epiretinica | ||
| Cataratta pediatrica |
Nel caso inoltre dei FANS contenenti conservanti (per es. benzalconio cloruro), è necessario uno stretto monitoraggio in caso di uso frequente o prolungato [29].
Key messages
- È noto che l’infiammazione riveste un ruolo importante nella comparsa e progressione dell’edema maculare cistoide (EMC) e di altre complicanze post-intervento di cataratta.
- I principali benefici associati all’utilizzo dei FANS nel pre-operatorio comprendono l’attività antinfiammatoria, la prevenzione della miosi, l’effetto antalgico, la prevenzione e il trattamento dell’EMC.
- I dati disponibili in letteratura dimostrano l’efficacia dei FANS nella prevenzione dell’EMC e rivelano che l’associazione di FANS e corticosteroidi, nel post operatorio, è più efficace e vantaggiosa rispetto all’utilizzo del solo corticosteroide.
- Iniziare la terapia antinfiammatoria, da 1 a 3 giorni prima dell’intervento, consente di ottenere risultati significativamente migliori, rispetto alla terapia nel solo peri-post operatorio, in termini di aumento del diametro pupillare, riduzione dell’infiammazione post-operatoria e riduzione dell’incidenza di EMC.
Approccio terapeutico consigliato per l’impiego dei FANS nella chirurgia della cataratta
Periodo pre-chirurgico: in base alle evidenze della letteratura e all’esperienza del Board, si raccomanda l’utilizzo dei FANS da 1 a 3 giorni prima dell’intervento. Non è invece consigliata la somministrazione di antibiotici prima dell’intervento [secondo le raccomandazioni dell’Agenzia Europea per i Medicinali (EMA) per la prevenzione dell’antibiotico-resistenza].
Periodo intra-operatorio: in accordo con le Linee Guida della Società Oftalmologica Italiana sulla Chirurgia della Cataratta, ai fini della prevenzione dell’endoftalmite la somministrazione di antibiotico attraverso il sistema d’infusione o in camera anteriore prima della fine dell’intervento è diffusa, pur in assenza di evidenze scientifiche di valore equivalente a quelle sull’impiego dello iodopovidone al 5% [30].
Periodo post-chirurgico: l’approccio terapeutico più diffuso nell’immediato postoperatorio si basa sulla somministrazione topica di antibiotico, cortisonico e FANS:
a. Prima settimana: FANS + associazione fissa antibiotico/steroide (2 colliri): visto il crescente fenomeno dell’antibiotico-resistenza [31,32], si raccomanda l’utilizzo di antibiotici per un periodo di tempo non superiore a 7 giorni [33].
b. Seconda e terza settimana: FANS + corticosteroide a giudizio del chirurgo.
c. L’utilizzo prolungato del FANS può essere previsto a discrezione del clinico.
Disclosure
P. L. C. received honoraria from Abbvie, Almirall, Amgen, Amicus, Angelini, Astellas, AstraZeneca, Bausch & Lomb, Bayer, Bial, Biogen, Boheringer Ingelheim, Celgene, Ferring, Grunenthal, Intercept, Jazz Pharmaceuticals, Kiowa, Leo-Pharma, Lilly, Lundbeck, Menarini, Merck Serono, MSD, Novartis, Novo Nordisk, Otsuka, Pierre Fabre, Roche, Sanofi, Shire, Takeda, Tesaro, UCB. Other authors have nothing to disclose.
Bibliografia
- 1. Ahuja M, Dhake AS, Sharma SK, Majumdar DK. Topical ocular delivery of NSAIDs. AAPS J 2008 Jun;10(2):229-41.
- 2. Kim SJ, Flach AJ, Jampol LM. Nonsteroidal anti-inflammatory drugs in ophthalmology. Surv Ophthalmol 2010;55:108-33.
- 3. Cho H, Mozayan A. New look at ocular inflammation control – Powerful and fast-acting twice-daily bromfenac for a novel standard in the treatment of inflammation. European Ophthalmic Review 2011;5(1):20-6.
- 4. El-Harazi SM, Feldman RM. Control of intraocular inflammation associated with cataract surgery. Curr Opin Ophthalmol 2001;12(1):4-8.
- 5. Masket S, Chang DF, Lane SS et al. American Academy of Ophthalmology. Cataract in the Adult Eye, Preferred Practice Pattern. San Francisco, CA: American Academy of Ophthalmology; 2006
- 6. Baklayan GA, Patterson HM, Song CK et al. 24-hour evaluation of the ocular distribution of (14)C-labeled bromfenac following topical instillation into the eyes of New Zealand white rabbits. J Ocul Pharmacol Ther 2008;24(4):392-8.
- 7. Hoffman RS, Braga-Mele R, Donaldson K et al. Cataract surgery and non-steroidal anti-inflammatory drugs. J Cataract Refract Surg 2016 Sep;42(9):1368-79.
- 8. Walsh DA, Moran HW, Shamblee DA et al. Anti-inflammatory agents. Synthesis and pharmacological evaluation of 2-amino-3-benzoylphenylacetic acid and analogues. J Med Chem 1984;11:1379-88.
- 9. Kida T, Kozai S, Takahashi H et al. Pharmacokinetics and efficacy of topically applied nonsteroidal anti-inflammatory drugs in retinochoroidal tissues in rabbits. PLoS ONE 2014;9(5):e96481.
- 10. Cervantes-Coste G, Sánchez-Castro YG, Orozco-Carroll M et al. Inhibition of surgically induced miosis and prevention of postoperative macular edema with nepafenac. Clin Ophthalmol 2009;3:219-26.
- 11. Donnenfeld ED, Holland EJ, Stewart RH et al. Bromfenac ophthalmic solution 0.09% (Xibrom) for postoperative ocular pain and inflammation. Ophthalmology 2007 Sep;114(9):1653-62.
- 12. Stewart RH, Grillone LR, Shiffman ML et al. The systemic safety of bromfenac ophthalmic solution 0.09%. J Ocul Pharmacol Ther 2007 Dec;23(6):601-12.
- 13. Chen H, Lin H, Chen W et al. Topical 0.1% bromfenac sodium for intraoperative miosis prevention and prostaglandin E2 inhibition in femtosecond laser-assisted cataract surgery. J Ocul Pharmacol Ther 2017 Apr;33(3):193-201.
- 14. Diakonis VF, Kontadakis GA, Anagnostopoulos AG et al. Effects of short-term preoperative topical ketorolac on pupil diameter in eyes undergoing femtosecond laser-assisted capsulotomy. J Refract Surg 2017 Apr 1;33(4):230-4.
- 15. Flesner P, Sander B, Henning V et al. Cataract surgery on diabetic patients. A prospective evaluation of risk factors and complications. Acta Ophthalmol Scand 2002 Feb;80(1):19-24.
- 16. Kim SJ, Equi R, Bressler NM. Analysis of macular edema after cataract surgery in patients with diabetes using optical coherence tomography. Ophthalmology 2007 May;114(5):881-9.
- 17. Ray S, D’Amico DJ. Pseudophakic cystoid macular edema. Semin Ophthalmol 2002 Sep-Dec;17(3-4):167-80.
- 18. Nagpal M, Nagpal K, Nagpal PN. Postcataract cystoid macular edema. Ophthalmol Clin North Am 2001 Dec;14(4):651-9.
- 19. Ursell PG, Spalton DJ, Whitcup SM, Nussenblatt RB. Cystoid macular edema after phacoemulsification: relationship to blood-aqueous barrier damage and visual acuity. J Cataract Refract Surg 1999 Nov;25(11):1492-7.
- 20. Flach AJ. The incidence, pathogenesis and treatment of cystoid macular edema following cataract surgery. Trans Am Ophthalmol Soc 1998;96:557-634.
- 21. Mentes J, Erakgun T, Afrashi F, Kerci G. Incidence of cystoid macular edema after uncomplicated phacoemulsification. Ophthalmologica 2003;Nov-Dec;217(6):408-12.
- 22. Loewenstein A, Zur D. Postsurgical cystoid macular edema. Dev Ophthalmol 2010;47:148-59. doi: 10.1159/000320078. Epub 2010 Aug 10.
- 23. Kessel L, Tendal B, Jørgensen KJ et al. Post-cataract prevention of inflammation and macular edema by steroid and nonsteroidal anti-inflammatory eye drops: a systematic review. Ophthalmology 2014 Oct;121(10):1915-24.
- 24. Wielders LHP, Schouten JSAG, Winkens B et al. European multicenter trial of the prevention of cystoid macular edema after cataract surgery in nondiabetics: ESCRS PREMED study report 1. J Cataract Refract Surg 2018;44:429-39.
- 25. Kim SJ, Schoenberger SD, Thorne JE et al. Topical nonsteroidal anti-inflammatory drugs and cataract surgery: a report by the American Academy of Ophthalmology. Ophthalmology 2015 Nov;122(11):2159-68.
- 26. Wielders LHP, Lambermont VA, Schouten JSAG et al. Prevention of cystoid macular edema after cataract surgery in nondiabetic and diabetic patients: a systematic review and meta-analysis. Am J Ophthalmol 2015;160:968-981.e33.
- 27. Lim BX, Lim CHL, Lim DK et al. Prophylactic non-steroidal anti-inflammatory drugs for the prevention of macular oedema after cataract surgery. Cochrane Database Syst Rev 2016; issue 11. Article no. CD006683.
- 28. Martone G, Corbo V, Caporossi O, Caporossi A. Survey Aiccer sulle modalità di effettuazione della terapia antinfiammatoria nella chirurgia della cataratta. La Voce Aiccer 3/2013. Fabiano Editore.
- 29. Yellox (bromfenac). Riassunto delle Caratteristiche di Prodotto.
- 30. Haripriya A, Chang DF. Intracameral antibiotics during cataract surgery: evidence and barriers. Curr Opin Ophthalmol 2018 Jan;29(1):33-39.
- 31. Barry P, Cordovés L, Gardner S. ESCRS Guidelines for Prevention and Treatment of Endophthalmitis Following Cataract Surgery: Data, Dilemmas and Conclusions (2013). http://www.escrs.org/downloads/Endophthalmitis-Guidelines.pdf
- 32. Miller D. Update on the epidemiology and antibiotic resistance of ocular infections. Middle East Afr J Ophthalmol 2017 Jan-Mar;24(1):30-42.
- 33. Fernández-Rubio E, Urcelay JL, Cuesta-Rodriguez T. The antibiotic resistance pattern of conjunctival bacteria: a key for designing a cataract surgery prophylaxis. Eye (Lond). 2009 Jun;23(6):1321-8. doi: 10.1038/eye.2008.295. Epub 2008 Oct 3.